Unidades de Masa Atómica: Todo lo que necesitas saber para entenderla y usarla correctamente
La masa atómica es una propiedad fundamental de los átomos que nos permite conocer la cantidad de materia que poseen. Sin embargo, debido a la pequeñez de los átomos y las grandes cantidades en las que se presentan en la naturaleza, resulta poco práctico medir la masa de un solo átomo para determinar su masa atómica. Por esta razón, se han establecido unidades de medida específicas, conocidas como Unidades de Masa Atómica (uma) o dalton, que simplifican los cálculos y permiten comparar las masas relativas de diferentes átomos y moléculas.
En este artículo exploraremos más a fondo qué son las Unidades de Masa Atómica y cómo se utilizan en la química y la física. Veremos cómo se relacionan estas unidades con la masa de un átomo individual, así como su relación con la constante de avogadro y el concepto de mol. También aprenderemos cómo convertir masas en unidades de masa atómica a masas en gramos y viceversa, usando factores de conversión adecuados. Por último, analizaremos algunas aplicaciones prácticas de estas unidades en la vida cotidiana y en la investigación científica.
- ¿Qué es una unidad de masa atómica y por qué es importante?
- ¿Cómo se define una unidad de masa atómica y cómo se relaciona con la masa de un átomo?
- ¿Cuál es la diferencia entre una unidad de masa atómica y una masa atómica relativa?
- ¿Cómo se utiliza la unidad de masa atómica en la Química y la Física?
- ¿Cómo se convierte una cantidad en gramos a unidades de masa atómica y viceversa?
- ¿Cuáles son algunos ejemplos concretos de cómo calcular y usar unidades de masa atómica en problemas prácticos?
- ¿Qué ocurre cuando los átomos tienen una masa atómica fraccionada que no coincide con ninguna unidad de masa atómica conocida?
- ¿Existe alguna relación entre la unidad de masa atómica y la constante de Avogadro?
- ¿Qué otras aplicaciones o áreas de estudio utilizan unidades de masa atómica en sus cálculos?
- Es posible utilizar unidades de masa atómica para comparar el peso de diferentes elementos o compuestos
- Preguntas frecuentes (FAQ)
¿Qué es una unidad de masa atómica y por qué es importante?
Una unidad de masa atómica, también conocida como u, es una medida estándar utilizada en la física y la química para expresar la masa de átomos y moléculas. Se define como la doceava parte de la masa de un átomo de carbono-12, que es tomado como referencia. La unidad de masa atómica se utiliza para comparar las masas relativas de los diferentes átomos y moléculas, lo que resulta fundamental para entender la composición y propiedades de la materia.
La importancia de la unidad de masa atómica radica en su capacidad para simplificar los cálculos relacionados con la masa de los átomos y las moléculas. En lugar de tratar con números extremadamente pequeños o grandes, se utilizan valores relativos que permiten una fácil comparación entre diferentes especies químicas. Esto facilita el estudio de la química y la comprensión de fenómenos como la estequiometría, la reactividad química y las propiedades periódicas de los elementos.
Además, la unidad de masa atómica es especialmente útil en los campos de la física nuclear y la física de partículas, donde la masa de partículas subatómicas como protones, neutrones y electrones puede variar significativamente. Al expresar las masas en unidades de masa atómica, los científicos pueden enfocarse en las diferencias relativas entre estas partículas, lo que facilita el análisis y la interpretación de los datos experimentales.
Para utilizar correctamente las unidades de masa atómica, es necesario tener en cuenta que no representan la masa real de los átomos o las moléculas en gramos. En su lugar, se utilizan como una medida relativa con respecto a la masa de un átomo de carbono-12. Por lo tanto, los valores numéricos de las masas atómicas representan cuántas veces la masa de un átomo o molécula es mayor que la masa de un átomo de carbono-12.
¿Cómo se calcula la masa atómica promedio?
La masa atómica promedio de un elemento se calcula teniendo en cuenta las diferentes isotopos presentes en la naturaleza y su abundancia relativa. Cada isótopo contribuye a la masa atómica promedio en función de su abundancia y su masa individual. La fórmula para calcular la masa atómica promedio es:
Masa atómica promedio = (masa del isótopo 1 * abundancia del isótopo 1) + (masa del isótopo 2 * abundancia del isótopo 2) + ...
Donde cada término representa la masa del isótopo multiplicada por su abundancia relativa. La suma de todos estos términos da como resultado la masa atómica promedio del elemento considerado.
Es importante recordar que la masa atómica promedio no es necesariamente un número entero, ya que depende de las proporciones isotópicas presentes en la muestra analizada. Sin embargo, la masa atómica promedio se aproxima a un número entero cuando la proporción de un isótopo en particular es especialmente alta.
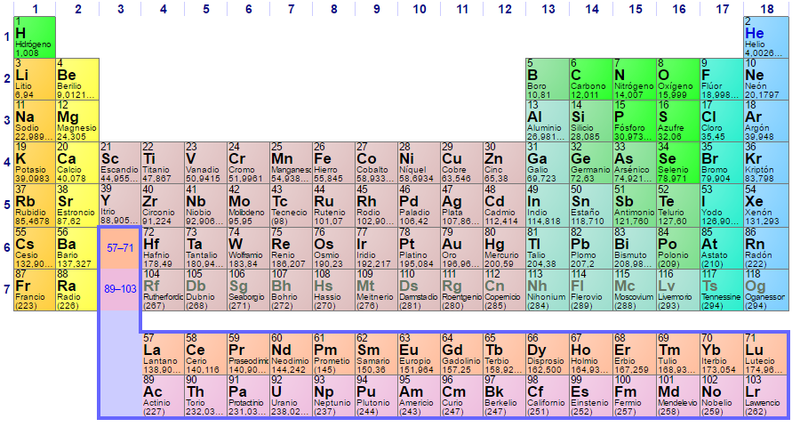
Unidades de masa atómica y la tabla periódica.
La unidad de masa atómica también es fundamental para entender y utilizar correctamente la tabla periódica de los elementos. En la tabla periódica, el número que aparece debajo del símbolo del elemento es la masa atómica relativa o el peso atómico promedio del elemento en unidades de masa atómica.
Esta masa atómica relativa se calcula de la manera ya mencionada, teniendo en cuenta las masas y las abundancias isotópicas de los diferentes isótopos presentes en la naturaleza. Estos valores de masa atómica relativa permiten comparar las masas de los elementos y reconocer patrones de comportamiento químico y propiedades periódicas.
Las unidades de masa atómica son esenciales en la química y la física para expresar las masas relativas de átomos y moléculas. Nos permiten simplificar cálculos, comparar especies químicas y entender la composición de la materia. Además, las unidades de masa atómica están estrechamente relacionadas con el cálculo de la masa atómica promedio de un elemento y el uso adecuado de la tabla periódica. Así que la próxima vez que te encuentres trabajando con masas de átomos y moléculas, recuerda la importancia de las unidades de masa atómica para entender y aplicar correctamente estos conceptos fundamentales.
¿Cómo se define una unidad de masa atómica y cómo se relaciona con la masa de un átomo?
Una unidad de masa atómica (uma) es una medida que se utiliza para indicar la masa de un átomo o de una partícula subatómica. Esta unidad es muy importante en el campo de la química y la física, ya que nos permite comparar las masas de diferentes elementos y conocer la cantidad de átomos presentes en una muestra determinada.
La unidad de masa atómica se define tomando como referencia la doceava parte de la masa de un átomo de carbono-12. Es decir, un átomo de carbono-12 tiene una masa aproximada de 12 unidades de masa atómica. A partir de esta referencia, podemos determinar las masas relativas de otros elementos, comparándolas con la masa del carbono-12.
Es importante tener en cuenta que la unidad de masa atómica no se corresponde directamente con las unidades de masa tradicionales, como los gramos o los kilogramos. Sin embargo, podemos establecer una relación entre ellas. Se ha definido que 1 uma equivale a aproximadamente 1.66 x 10^-27 kg.
Una de las aplicaciones más importantes de la unidad de masa atómica es la determinación de la fórmula molecular de una sustancia. Para ello, se utiliza la masa molar, que se expresa en gramos por mol. La masa molar de una sustancia se calcula sumando las masas atómicas de todos los átomos presentes en su fórmula química.
Para entender cómo se relaciona la unidad de masa atómica con la masa de un átomo, podemos tomar como ejemplo el hidrógeno. El hidrógeno tiene una masa atómica de aproximadamente 1.008 uma. Esto significa que la masa de un átomo de hidrógeno es aproximadamente 1/12 de la masa de un átomo de carbono-12.
Una unidad de masa atómica es una medida utilizada para comparar las masas de diferentes átomos y partículas subatómicas. Se define tomando como referencia la doceava parte de la masa de un átomo de carbono-12. Esta unidad nos permite determinar las masas relativas de otros elementos y realizar cálculos relacionados con la química y la física.
¿Cuál es la diferencia entre una unidad de masa atómica y una masa atómica relativa?
Para comprender correctamente la diferencia entre una unidad de masa atómica (u) y una masa atómica relativa, es importante tener claridad sobre el concepto de masa atómica. La masa atómica se refiere a la masa promedio de un átomo de un elemento en particular con respecto a la masa de un átomo de carbono-12, que se define como 12 unidades de masa atómica.
La unidad de masa atómica (u) es una unidad de medida estándar utilizada en química y física para expresar masas atómicas y moleculares. Es equivalente a la doceava parte de la masa de un átomo de carbono-12. Por lo tanto, una masa atómica relativa representa la masa de un átomo o molécula en relación con la unidad de masa atómica.
Entonces, ¿cuál es la diferencia entre ambas? La masa atómica relativa es un número adimensional que se utiliza para comparar las masas de diferentes átomos o moléculas. Por ejemplo, si se compara el hidrógeno (H) con el oxígeno (O), se puede decir que la masa atómica relativa del hidrógeno es aproximadamente 1, mientras que la del oxígeno es aproximadamente 16.
En cambio, la unidad de masa atómica (u) es una medida cuantitativa de la masa de un átomo o molécula específica en relación con la masa de un átomo de carbono-12. Es una forma más precisa y exacta de expresar la masa de un elemento. Por ejemplo, la masa atómica del hidrógeno es aproximadamente 1.00784 u, mientras que la del oxígeno es aproximadamente 15.999 u.
Es importante tener en cuenta que la masa atómica relativa es un valor más aproximado y redondeado, mientras que la unidad de masa atómica (u) proporciona una medida más precisa y detallada de la masa de los átomos o moléculas.
La diferencia radica en que la masa atómica relativa se utiliza para comparar las masas de diferentes átomos o moléculas, mientras que la unidad de masa atómica (u) es una medida cuantitativa precisa de la masa de un átomo o molécula específica con respecto a la masa de un átomo de carbono-12.
¿Cómo se utiliza la unidad de masa atómica en la Química y la Física?
La unidad de masa atómica (uma) es una unidad de medida utilizada en Química y Física para expresar la masa de átomos y moléculas. Es especialmente útil cuando se trabaja con partículas subatómicas, como electrones, protones y neutrones, cuyas masas individuales son extremadamente pequeñas.
En la teoría atómica moderna, se estableció el carbono-12 (^12C) como la referencia para la unidad de masa atómica. Se definió que un átomo de carbono-12 tiene una masa de exactamente 12 unidades de masa atómica. A partir de esta definición, se pudo establecer la masa relativa de otros elementos y compuestos.
¿Cómo se calcula la masa de un átomo o molécula utilizando a unidad de masa atómica?
Para calcular la masa de un átomo o molécula utilizando la unidad de masa atómica, se utiliza una comparación relativa entre la masa del átomo o molécula y la masa del carbono-12.
Por ejemplo, si queremos calcular la masa relativa de un átomo de hidrógeno (H), lo comparamos con la masa del carbono-12. La masa del hidrógeno se considera aproximadamente igual a 1 unidad de masa atómica. Por lo tanto, podemos decir que la masa relativa del hidrógeno es de 1 umas (unidad de masa atómica).
Del mismo modo, si tenemos una molécula de agua (H2O), podemos calcular su masa relativa sumando las masas relativas de los átomos que la componen. Un mol de agua contiene 2 átomos de hidrógeno y 1 átomo de oxígeno. La masa del oxígeno se considera aproximadamente igual a 16 unidades de masa atómica, mientras que la masa del hidrógeno es de 1 unidad de masa atómica. Por lo tanto, podemos decir que la masa relativa del agua es de 18 umas.
Importancia de la unidad de masa atómica en la Química y la Física
La unidad de masa atómica es fundamental en la Química y la Física, ya que nos permite comparar las masas de diferentes átomos y moléculas de manera precisa y coherente. Al utilizar esta unidad de medida, podemos entender mejor las proporciones en las reacciones químicas y calcular con precisión las cantidades de sustancias involucradas.
Además, la unidad de masa atómica también es esencial en el estudio de la estructura de la materia. Nos proporciona información sobre cómo los átomos se unen para formar moléculas y cómo estas moléculas interactúan entre sí. También nos ayuda a comprender fenómenos físicos como la energía nuclear y las reacciones de fisión y fusión.
La unidad de masa atómica es una herramienta invaluable en la Química y la Física, ya que nos permite medir y comparar las masas relativas de átomos y moléculas. Su uso es esencial para comprender las propiedades y comportamiento de la materia a nivel subatómico y para realizar cálculos precisos en diversas áreas científicas.
¿Cómo se convierte una cantidad en gramos a unidades de masa atómica y viceversa?
La conversión entre cantidades en gramos y unidades de masa atómica es un proceso fundamental cuando se trabaja en química y física, especialmente en el campo de la estructura atómica. Las unidades de masa atómica, abreviadas como uma o amu, son utilizadas para medir la masa relativa de los átomos y las moléculas. Aunque su relación con los gramos puede parecer complicada, existe una fórmula simple para realizar esta conversión.
Para convertir una cantidad en gramos a unidades de masa atómica, se utiliza la fórmula:
masa en umas = masa en gramos / masa molar en g/mol
Donde "masa en gramos" es la cantidad dada en gramos y "masa molar en g/mol" es la masa molar del elemento o compuesto en cuestión, medida en gramos por mol. La masa molar se puede encontrar fácilmente en la tabla periódica, donde se indica en la fila correspondiente al elemento.
Por ejemplo, si queremos convertir 10 gramos de oxígeno a unidades de masa atómica, utilizamos la fórmula de conversión. La masa molar del oxígeno es aproximadamente 16 g/mol. Sustituyendo estos valores en la fórmula, obtenemos:
masa en umas = 10 g / 16 g/mol ≈ 0.625 umas
Por lo tanto, 10 gramos de oxígeno equivalen aproximadamente a 0.625 unidades de masa atómica.
En el caso contrario, convertir una cantidad en unidades de masa atómica a gramos, se utiliza la fórmula inversa:
masa en gramos = masa en umas * masa molar en g/mol
Utilizando esta fórmula, podemos convertir una masa dada en unidades de masa atómica a gramos. La masa molar sigue siendo la misma, pero ahora conocemos la masa en unidades de masa atómica y queremos encontrar la masa correspondiente en gramos. Solo necesitamos multiplicar la masa en umas por la masa molar del elemento.
Por ejemplo, si tenemos 2 unidades de masa atómica de hidrógeno y queremos conocer su masa en gramos, utilizamos la fórmula de conversión. La masa molar del hidrógeno es aproximadamente 1 g/mol. Realizando el cálculo, obtenemos:
masa en gramos = 2 umas * 1 g/mol = 2 g
Por lo tanto, 2 unidades de masa atómica de hidrógeno equivalen a 2 gramos.
Es importante recordar que estas conversiones son útiles para trabajar con partículas individuales o moléculas, pero pueden no ser adecuadas cuando se trabaja con cantidades mayores o en otros contextos específicos. También debemos considerar las cifras significativas y redondear correctamente los resultados según las reglas apropiadas para cada cálculo.
¿Cuáles son algunos ejemplos concretos de cómo calcular y usar unidades de masa atómica en problemas prácticos?
Las unidades de masa atómica (uma) son fundamentales en la química y la física, ya que nos permiten medir las masas de átomos y moléculas de manera precisa. Aunque a primera vista pueda parecer un concepto complicado, entender y usar correctamente estas unidades es esencial para poder realizar cálculos e interpretar resultados con precisión.
Cuando se trata de calcular y usar unidades de masa atómica en problemas prácticos, hay varios ejemplos concretos que pueden ayudarnos a comprender mejor su aplicación. Uno de los casos más comunes es el cálculo de la masa atómica promedio de un elemento o compuesto. Para ello, es necesario conocer las masas atómicas individuales de los elementos que lo componen y la proporción en la que se encuentran.
Por ejemplo, si queremos calcular la masa atómica promedio del agua (H2O), primero debemos saber que el hidrógeno tiene una masa atómica de aproximadamente 1 uma y el oxígeno tiene una masa atómica de aproximadamente 16 uma. Sabiendo que en una molécula de agua hay dos átomos de hidrógeno y uno de oxígeno, podemos utilizar esta información para calcular la masa atómica promedio:
Masa atómica promedio del agua = (m1 * n1 + m2 * n2) / (n1 + n2)
Donde m1 y m2 representan las masas atómicas de los elementos (en este caso, hidrógeno y oxígeno), y n1 y n2 representan las proporciones en las que se encuentran en la molécula (en este caso, 2 y 1, respectivamente). Aplicando la fórmula, tenemos:
Masa atómica promedio del agua = (1 uma * 2 + 16 uma * 1) / (2 + 1) = 18 uma
Así, podemos concluir que la masa atómica promedio del agua es de 18 unidades de masa atómica.
Otro ejemplo práctico de uso de unidades de masa atómica es el cálculo de la cantidad de sustancia en una muestra. Si conocemos la masa de la muestra y la masa molar de la sustancia, podemos utilizar la siguiente fórmula:
Cantidad de sustancia = Masa de la muestra / Masa molar
Por ejemplo, si tenemos una muestra de 36 g de ácido sulfúrico (H2SO4) y conocemos que su masa molar es de aproximadamente 98 g/mol, podemos calcular la cantidad de sustancia utilizando la fórmula:
Cantidad de sustancia = 36 g / 98 g/mol ≈ 0.367 mol
El resultado nos indica que en la muestra hay aproximadamente 0.367 moles de ácido sulfúrico.
Estos son solo algunos ejemplos concretos de cómo calcular y usar unidades de masa atómica en problemas prácticos. Sin embargo, es importante recordar que cada situación puede requerir un enfoque particular y que es fundamental comprender los fundamentos teóricos detrás de estas unidades para poder aplicarlas correctamente en diferentes contextos.
¿Qué ocurre cuando los átomos tienen una masa atómica fraccionada que no coincide con ninguna unidad de masa atómica conocida?
La masa atómica es una propiedad fundamental de los átomos que se utiliza para comparar las masas relativas de diferentes elementos químicos. La unidad utilizada para expresar la masa atómica es la Unidad de Masa Atómica (uma) o, en inglés, Atomic Mass Unit (AMU).
Generalmente, la masa atómica de un átomo se mide en uma y se redondea al número entero más cercano. Sin embargo, existen casos en los que los átomos tienen una masa atómica fraccionada que no coincide con ninguna unidad de masa atómica conocida.
Cuando esto ocurre, es necesario hacer uso de la notación estándar o la notación científica para expresar la masa atómica de manera adecuada. En la notación estándar, se utiliza el número decimal exacto de la masa atómica, mientras que en la notación científica se emplea una expresión matemática que incluye el valor de la masa atómica y el exponente correspondiente.
Notación Estándar
En la notación estándar, cuando un átomo tiene una masa atómica fraccionada, se escribe el número decimal exacto sin redondear. Por ejemplo, si un átomo tiene una masa atómica de 1.5 uma, se escribiría como 1.5 uma en notación estándar. Esto permite tener una mayor precisión en la expresión de la masa atómica de un átomo.
Notación Científica
En la notación científica, también conocida como notación exponencial o notación en forma de potencia, se utiliza una expresión matemática para representar un número de manera compacta. Esta notación es especialmente útil para escribir números muy grandes o muy pequeños.
Para expresar la masa atómica fraccionada en notación científica, se utiliza la siguiente fórmula:
masa_atómica = valor*10^exponente
Donde el "valor" corresponde al número decimal exacto de la masa atómica y el "exponente" indica cuántas veces se debe multiplicar ese valor por 10. Por ejemplo, si un átomo tiene una masa atómica de 1.5 uma, en notación científica se expresaría como 1.5*10^0 uma.
La notación científica permite simplificar la escritura de números muy grandes o muy pequeños, facilitando su comprensión y comparación. Además, es una forma estándar ampliamente aceptada en el campo de la ciencia y la investigación.
Cuando los átomos tienen una masa atómica fraccionada que no coincide con ninguna unidad de masa atómica conocida, es necesario utilizar la notación estándar o la notación científica para expresar adecuadamente su masa atómica. Ambas formas permiten una mayor precisión y facilitan la comprensión y comparación de los valores de masa atómica de los diferentes elementos químicos.
¿Existe alguna relación entre la unidad de masa atómica y la constante de Avogadro?
La unidad de masa atómica (uma) es una escala utilizada para expresar la masa de los átomos y moléculas. Se define como una doceava parte de la masa de un átomo de carbono-12, y se utiliza para comparar las masas de diferentes elementos en el ámbito de la química y la física.
Por otro lado, la constante de Avogadro es una cantidad fundamental en la teoría cinético-molecular y la estequiometría. Representada por el símbolo "NA", es igual al número de átomos y moléculas contenidos en un mol, que es una cantidad fija de sustancia. En términos numéricos, su valor es aproximadamente 6.022 × 1023 unidades/mol.
A pesar de representar conceptos diferentes, existe una relación indirecta entre la unidad de masa atómica y la constante de Avogadro. Esta relación se establece a través de la masa molar, la cual se expresa en gramos/mol y está relacionada con la masa atómica relativa de un elemento o compuesto.
Para entender mejor esta relación, es necesario considerar la masa molar de un elemento específico o de una molécula compuesta por átomos de diferentes elementos. La masa molar se obtiene sumando las masas atómicas relativas de los átomos que componen el elemento o compuesto. Por ejemplo, la masa molar del agua (H2O) es igual al doble de la masa atómica relativa del hidrógeno (1) más la masa atómica relativa del oxígeno (16), lo que resulta en una masa molar de 18 g/mol.
Al relacionar la masa molar con la constante de Avogadro, se obtiene la relación siguiente:
masa molar (g/mol) = masa atómica (uma) x NA
Esta relación nos permite convertir entre masa molar y masa atómica utilizando tanto la unidad de masa atómica como la constante de Avogadro. Por ejemplo, si se desea determinar la masa de un mol de átomos de carbono, utilizando la masa molar del carbono y la constante de Avogadro:
masa molar del carbono = 12 g/mol
masa de un mol de átomos de carbono = 12 g/mol x NA
De esta manera, la unidad de masa atómica y la constante de Avogadro están relacionadas indirectamente a través de la masa molar, permitiendo realizar conversiones entre diferentes unidades de masa y cantidades de sustancia. Esta relación es fundamental en cálculos químicos y físicos, así como en la comprensión de las propiedades de los elementos y compuestos.
¿Qué otras aplicaciones o áreas de estudio utilizan unidades de masa atómica en sus cálculos?
Las unidades de masa atómica, también conocidas como amu (por sus siglas en inglés Atomic Mass Unit), son utilizadas en una amplia variedad de aplicaciones y áreas de estudio que abarcan desde la química hasta la física nuclear. A continuación, te presentamos algunas de las principales áreas en las que se utilizan estas unidades:
Química:
En química, las unidades de masa atómica son fundamentales para el cálculo de la masa de los átomos y las moléculas. Se utilizan para determinar la masa molar de los compuestos y realizar conversiones entre masa y cantidad de sustancia. La masa atómica relativa de los elementos, expresada en unidades de masa atómica, es un dato clave para realizar cálculos estequiométricos y formular reacciones químicas.
Física de partículas:
En física de partículas, las unidades de masa atómica son utilizadas para medir la masa de las partículas subatómicas, como electrones, protones y neutrones. Estas masas se expresan en términos de múltiplos o fracciones de la masa del átomo de carbono-12, que se define exactamente como 12 unidades de masa atómica. El estudio de la masa de las partículas subatómicas es fundamental para comprender la estructura y las interacciones de la materia a nivel más fundamental.
Física nuclear:
En física nuclear, las unidades de masa atómica son utilizadas para determinar la masa de los núcleos atómicos. La masa nuclear es fundamental para calcular la energía de enlace de los núcleos y predecir su estabilidad. Además, las unidades de masa atómica son utilizadas para medir la energía liberada en reacciones nucleares, como la fusión y la fisión nuclear.
Astronomía:
En astronomía, las unidades de masa atómica son utilizadas para describir la masa de los cuerpos celestes, como planetas, estrellas y galaxias. Estas masas se expresan en términos de múltiplos o fracciones de la masa del Sol, que se define aproximadamente como 332 946 unidades de masa atómica. Las unidades de masa atómica son esenciales para comprender la estructura y la evolución de los sistemas astrofísicos.
Medicina nuclear:
En medicina nuclear, las unidades de masa atómica son utilizadas para medir y administrar isótopos radioactivos en procedimientos diagnósticos y terapéuticos. La masa atómica relativa de los isótopos radiactivos es un dato crucial para determinar su vida media y su capacidad de emitir radiación ionizante. Las unidades de masa atómica también son utilizadas para calibrar los equipos de detección de radiación utilizados en medicina nuclear.
Las unidades de masa atómica tienen aplicaciones en diversas áreas científicas y tecnológicas. Son fundamentales en campos como la química, la física de partículas, la física nuclear, la astronomía y la medicina nuclear. Su uso adecuado y comprensión es vital para realizar cálculos precisos y comprender fenómenos físicos y químicos a nivel atómico y subatómico.
Es posible utilizar unidades de masa atómica para comparar el peso de diferentes elementos o compuestos
Las unidades de masa atómica, también conocidas como amu (por sus siglas en inglés Atomic Mass Unit), son una forma de medir la masa de átomos y moléculas. Estas unidades son fundamentales en el campo de la química, ya que permiten realizar comparaciones precisas entre los diferentes elementos o compuestos.
La unidad de masa atómica se define a partir de la masa de un átomo de carbono-12 (^12C), el cual se toma como referencia y se le asigna un valor exacto de 12 amu. A partir de esta base, es posible calcular las masas relativas de los demás elementos y compuestos en relación con el carbono-12.
Es importante destacar que la masa atómica no debe confundirse con la masa molar. Mientras que la masa atómica se refiere a la masa de un solo átomo o molécula, la masa molar representa la masa promedio de un mol de sustancia. La masa molar se expresa en gramos por mol (g/mol) y se obtiene sumando las masas atómicas de los átomos que componen una molécula.
¿Cómo se utiliza la unidad de masa atómica?
La unidad de masa atómica se utiliza principalmente para comparar las masas de diferentes átomos o moléculas. Al conocer la masa atómica de un elemento o compuesto, es posible determinar cuántas veces su masa difiere de la masa del carbono-12.
Por ejemplo, si deseamos comparar la masa de un átomo de oxígeno con la del carbono-12, sabemos que el oxígeno tiene una masa atómica de aproximadamente 16 amu. Esto significa que el átomo de oxígeno es 16 veces más pesado que el átomo de carbono-12.
La unidad de masa atómica también es útil para realizar cálculos estequiométricos, que involucran la relación entre las cantidades de sustancias en una reacción química. Al conocer la masa molar de los compuestos involucrados, es posible determinar la proporción en la que reaccionan y se forman productos.
Unidades de masa atómica y la tabla periódica
La tabla periódica de los elementos es un recurso fundamental en la química, y en ella se encuentran listadas las masas atómicas relativas de los diferentes elementos. Estas masas atómicas están expresadas en unidades de masa atómica.
En la tabla periódica, el número que aparece debajo del símbolo del elemento corresponde a su masa atómica. Por ejemplo, el hidrógeno (H) tiene una masa atómica de aproximadamente 1 amu, mientras que el helio (He) tiene una masa atómica de aproximadamente 4 amu.
Con base en la información proporcionada por la tabla periódica, es posible calcular la masa molar de un compuesto sumando las masas atómicas de los elementos que lo componen. Esta información resulta fundamental para realizar cálculos estequiométricos y determinar la cantidad de sustancias involucradas en una reacción química.
Las unidades de masa atómica son una herramienta fundamental en la química para comparar y calcular masas relativas de elementos y compuestos. Su uso se encuentra estrechamente relacionado con la tabla periódica de los elementos y resulta clave en diferentes áreas de estudio y aplicación de la ciencia.
Preguntas frecuentes (FAQ)
1. ¿Qué es una Unidad de Masa Atómica (uma)?
La uma es una unidad utilizada para expresar masas atómicas y moleculares en la escala del átomo de carbono-12.
2. ¿Cuál es la relación entre la uma y el gramo?
Un gramo es igual a aproximadamente 6.022 x 10^23 unidades de masa atómica.
3. ¿Por qué se utiliza la uma en lugar de los gramos en ciertos contextos?
La uma se utiliza en química y física debido a que las masas atómicas y moleculares son extremadamente pequeñas y difíciles de expresar en gramos. La uma proporciona una escala más conveniente para estos cálculos.
4. ¿Cómo se calcula la masa de un átomo utilizando la uma?
La masa de un átomo se calcula sumando las masas de sus protones, neutrones y electrones. Cada tipo de partícula tiene una masa específica en uma y se multiplican por su número respectivo.
5. ¿Puedo convertir una masa en uma a gramos y viceversa?
Sí, puedes convertir masas en uma a gramos multiplicando o dividiendo por el factor de conversión adecuado. Recuerda que 1 uma equivale a aproximadamente 1.66054 x 10^-24 gramos.
Deja una respuesta
Entradas relacionadas