El fascinante modelo atómico actual: descubre los secretos de la estructura de la materia
Desde los tiempos de los antiguos filósofos griegos hasta el desarrollo de la física cuántica en el siglo , la comprensión de la estructura de la materia ha sido un tema apasionante para científicos de todas las épocas. A medida que avanzamos en nuestras capacidades tecnológicas y técnicas experimentales, hemos logrado desarrollar un modelo cada vez más preciso y detallado del átomo, la unidad básica de la materia.
Exploraremos el fascinante modelo atómico actual y sus principales fundamentos. Descubriremos cómo diferentes partículas subatómicas interactúan entre sí, cómo se organizan en niveles de energía y cuál es la importancia de entender esta estructura para abordar importantes áreas de investigación, como la química y la física nuclear. Además, también examinaremos cómo estos conocimientos han permitido avances tecnológicos y aplicaciones prácticas en áreas como la medicina y la energía nuclear.
- Qué es un modelo atómico y por qué es importante
- El modelo atómico: un vistazo a la estructura de la materia
- Antiguos modelos atómicos: de Demócrito a Dalton
- El modelo de Thomson y el descubrimiento del electrón
- El experimento de Rutherford y el núcleo atómico
- El modelo atómico actual: una visión cuántica
- Aplicaciones del modelo atómico en la tecnología moderna
- Cómo ha evolucionado el modelo atómico a lo largo de la historia
- Cuál es el modelo atómico actualmente aceptado por la comunidad científica
- Cuáles son las principales características del modelo atómico actual
- Cuáles son las partículas subatómicas y cómo se relacionan con el modelo atómico
- Cómo contribuye el modelo atómico actual a nuestra comprensión de la estructura de la materia
- Cuáles son los avances recientes en el estudio del modelo atómico
- Cómo se utilizan los conocimientos del modelo atómico en diversas áreas, como la química y la física
- Qué impacto ha tenido el modelo atómico actual en el desarrollo de nuevas tecnologías
- Cuáles son algunas aplicaciones prácticas del modelo atómico en la vida cotidiana
- Preguntas frecuentes (FAQ)
Qué es un modelo atómico y por qué es importante
El modelo atómico: un vistazo a la estructura de la materia
El modelo atómico es una representación conceptual de cómo se organizan los átomos, las partículas más pequeñas de la materia. A lo largo de la historia, distintos científicos han contribuido con teorías y modelos sobre la estructura de los átomos, lo que ha llevado a la evolución de nuestro conocimiento actual.
La importancia del modelo atómico radica en que nos permite comprender y explicar los fenómenos químicos y físicos que ocurren a nivel microscópico. Al entender cómo se organizan los átomos en un material determinado, podemos predecir su comportamiento y desarrollar nuevas tecnologías o aplicaciones.
Antiguos modelos atómicos: de Demócrito a Dalton
El primer científico en proponer la idea de que la materia está formada por partículas indivisibles fue Demócrito en el siglo V a.C. Sin embargo, su teoría carecía de fundamentos científicos sólidos y no fue ampliamente aceptada en su época.
Fue en el siglo I cuando John Dalton desarrolló el primer modelo atómico basado en evidencias experimentales. Dalton postuló que los átomos eran esferas indivisibles y que los diferentes elementos estaban compuestos por átomos de distintos tamaños y masas.
Este modelo atómico fue revolucionario en su momento, ya que explicaba la ley de las proporciones definidas y múltiples, es decir, que los elementos combinan en proporciones fijas para formar compuestos.
El modelo de Thomson y el descubrimiento del electrón
A fines del siglo I, Joseph John Thomson descubrió la existencia de partículas subatómicas cargadas negativamente, a las que denominó electrones. Esto llevó a una nueva visión sobre la estructura del átomo.
Thomson propuso un modelo atómico conocido como el "budín de pasas", en el cual los electrones estaban incrustados en una masa positiva similar a un pudin. Esta representación introdujo la idea de que los átomos no eran indivisibles, sino que tenían una estructura interna más compleja.
Aunque el modelo de Thomson fue un avance importante, aún quedaban muchas preguntas sin responder sobre la naturaleza de los átomos y su estructura interna.
El experimento de Rutherford y el núcleo atómico
En 1911, Ernest Rutherford realizó un famoso experimento en el que bombardeó una fina lámina de oro con partículas alfa. Para sorpresa de Rutherford, algunas partículas alfa rebotaron de manera inesperada, lo que indicaba que los átomos no eran macizos como se pensaba hasta ese momento.
Basado en estos resultados, Rutherford propuso un nuevo modelo atómico en el cual los átomos tenían un núcleo pequeño y denso en su centro, cargado positivamente, alrededor del cual orbitaban los electrones a gran distancia.
Este modelo atómico, conocido como "modelo de Rutherford", revolucionó nuestra comprensión de la estructura de la materia y fue un paso crucial hacia el modelo actual.
El modelo atómico actual: una visión cuántica
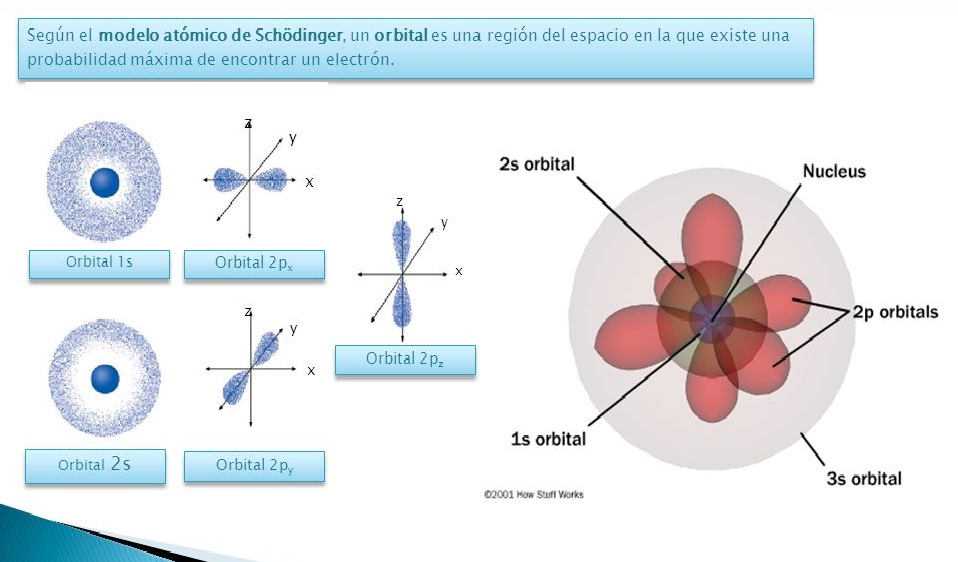
A medida que avanzaba el siglo , los científicos descubrieron más detalles sobre la estructura interna del átomo. Se demostró que los electrones no orbitan alrededor del núcleo en órbitas fijas, sino que existen en regiones de alta probabilidad llamadas orbitales.
El modelo atómico actual, basado en la teoría cuántica, describe los átomos como sistemas cuánticos con propiedades ondulatorias y corpusculares. Según este modelo, los electrones se encuentran en estados cuánticos definidos por su energía y momento angular.
Además, el modelo actual también introduce la idea de los números cuánticos y los niveles de energía de los electrones. Estos números cuánticos especifican la ubicación y características de los electrones dentro de un átomo.
Aplicaciones del modelo atómico en la tecnología moderna
Gracias al modelo atómico, hemos podido desarrollar numerosas tecnologías y aplicaciones en diferentes campos. La electrónica, la energía nuclear, la medicina y la nanotecnología son solo algunos ejemplos de áreas en las que nuestro conocimiento de la estructura de la materia ha sido fundamental.
En electrónica, el modelo atómico nos permite entender cómo funcionan los dispositivos electrónicos, como transistores y circuitos integrados. En la energía nuclear, nos ayuda a comprender las reacciones nucleares y desarrollar fuentes de energía más limpias y eficientes.
En medicina, el conocimiento sobre la estructura de los átomos permite el desarrollo de técnicas de diagnóstico por imágenes, como la resonancia magnética, así como la investigación en tratamientos más efectivos contra enfermedades.
La nanotecnología, por su parte, se basa en la manipulación de átomos y moléculas para crear materiales y dispositivos con propiedades únicas, con aplicaciones en campos tan diversos como la electrónica, la medicina y la industria.
El modelo atómico es un pilar fundamental en nuestra comprensión de la estructura de la materia. A lo largo de la historia, hemos avanzado desde la idea de átomos indivisibles hasta una descripción cuántica compleja y precisa.
Nuestro conocimiento actual nos ha brindado un panorama fascinante sobre cómo se organizan los átomos y cómo esto afecta las propiedades y comportamiento de la materia. Además, ha impulsado el desarrollo de tecnologías innovadoras que impactan nuestras vidas en múltiples aspectos.
El estudio continuo del modelo atómico y sus aplicaciones promete seguir desvelando los secretos de la estructura de la materia y abrir nuevas posibilidades en el futuro.
Cómo ha evolucionado el modelo atómico a lo largo de la historia
El modelo atómico es una representación conceptual de la estructura interna de los átomos, que son las unidades básicas que conforman la materia. A lo largo de la historia, este modelo ha experimentado diferentes evoluciones y cambios significativos a medida que los científicos han ido descubriendo nuevos aspectos sobre la naturaleza de la materia.
En la antigua Grecia, los filósofos griegos Demócrito y Leucipo propusieron por primera vez la idea de que la materia estaba compuesta por partículas indivisibles llamadas átomos. Sin embargo, esta teoría no fue aceptada ampliamente en ese momento y se necesitaron siglos de avances científicos para desarrollar un modelo más completo del átomo.
Modelo de Dalton
A principios del siglo I, el químico inglés John Dalton formuló una teoría que establecía cuatro postulados fundamentales sobre la estructura de los átomos. Según su modelo, los átomos eran partículas indivisibles con propiedades únicas para cada elemento, y las reacciones químicas se producían debido a la combinación y separación de átomos individuales.
Si bien el modelo de Dalton fue un gran avance en su época, pronto surgieron evidencias experimentales que demostraron que los átomos no eran indivisibles y tenían una estructura interna más compleja.
Modelo de Thomson
A finales del siglo I, el físico británico J.J. Thomson descubrió la existencia de partículas subatómicas llamadas electrones. Basándose en sus experimentos con tubos de vacío, propuso un nuevo modelo para el átomo en el que los electrones estaban incrustados en una esfera de carga positiva uniforme.
Este modelo, conocido como el "modelo del pudín de pasas", fue una mejora significativa sobre la teoría de Dalton y ayudó a explicar fenómenos como la conductividad eléctrica y la naturaleza cargada de los átomos. Sin embargo, aún quedaban preguntas sin responder sobre las partes fundamentales del átomo.
Modelo de Rutherford
A principios del siglo , el físico neozelandés Ernest Rutherford llevó a cabo el famoso experimento de la lámina de oro, en el cual bombardeó una delgada lámina de oro con partículas alfa. Sorprendentemente, algunas partículas rebotaron en ángulos inesperados, lo que indicaba que los átomos tenían una pequeña región de carga positiva concentrada en su núcleo y una gran cantidad de espacio vacío alrededor.
Basado en estos resultados, Rutherford propuso un nuevo modelo atómico en el que los electrones giraban alrededor de un núcleo cargado positivamente. Este modelo fue una verdadera revolución en la comprensión de la estructura del átomo y sentó las bases para desarrollos posteriores.
Modelo de Bohr
Poco después, el físico danés Niels Bohr desarrolló una versión refinada del modelo de Rutherford, conocido como el modelo de Bohr. Según esta teoría, los electrones se movían en órbitas circulares alrededor del núcleo en niveles de energía cuantizados.
El modelo de Bohr pudo explicar con éxito las líneas espectrales observadas en los espectros electrónicos y proporcionó una comprensión más profunda de las transiciones electrónicas. Sin embargo, también presentaba limitaciones, ya que no podía explicar completamente el comportamiento de átomos más grandes o la naturaleza ondulatoria de los electrones.
Modelo actual: Mecánica Cuántica
La evolución del modelo atómico continuó con los avances en la física cuántica a principios del siglo . La teoría de la mecánica cuántica ha llevado a un entendimiento más completo y preciso de la estructura del átomo y de las partículas subatómicas.
Según la mecánica cuántica, los electrones no siguen trayectorias definidas, sino que existen en regiones de alta probabilidad llamadas orbitales. Estos orbitales representan la distribución de la nube electrónica alrededor del núcleo y proporcionan información sobre la densidad de electrones en diferentes puntos del espacio.
Además, la mecánica cuántica también describe la existencia de partículas subatómicas llamadas quarks, que constituyen los protones y neutrones en el núcleo atómico.
El modelo atómico ha experimentado grandes transformaciones a lo largo de la historia, desde el concepto inicial de átomos indivisibles hasta la comprensión actual basada en la mecánica cuántica. Estos avances nos han permitido adentrarnos en los fascinantes secretos de la estructura de la materia y entender mejor el funcionamiento del mundo que nos rodea.
Cuál es el modelo atómico actualmente aceptado por la comunidad científica
El modelo atómico actualmente aceptado por la comunidad científica es conocido como el modelo cuántico, también llamado modelo mecano-cuántico. Este modelo revolucionario ha sido desarrollado a lo largo del siglo y ha redefinido nuestra comprensión de la estructura íntima de la materia.
El modelo cuántico se basa en los principios de la mecánica cuántica, una teoría fundamental que describe el comportamiento de las partículas subatómicas. Según este modelo, un átomo está constituido por un núcleo compacto en su centro, compuesto por protones y neutrones, rodeado por una nube de electrones que se mueven en órbitas o niveles de energía definidos.
Estos niveles de energía se dividen en capas electrónicas, cada una de las cuales puede albergar un número limitado de electrones. La primera capa electrónica, más cercana al núcleo, puede contener hasta 2 electrones, mientras que las siguientes capas pueden almacenar hasta 8 electrones. Sin embargo, es importante destacar que no todos los átomos tienen todas las capas completas, lo que explica las propiedades químicas únicas de cada elemento.
La importancia de los electrones
Los electrones juegan un papel crucial en la estructura de la materia, ya que son responsables de las interacciones eléctricas y químicas entre los átomos. Cada electrón tiene una carga negativa y orbita alrededor del núcleo en una posición determinada por la cantidad de energía que posee.
La cantidad de energía de un electrón está relacionada con su distancia al núcleo y se expresa en términos de niveles o estados cuánticos. Cuanto más cerca del núcleo se encuentre un electrón, menor será su nivel de energía y viceversa. Estos niveles energéticos se representan por números cuánticos, y cada número representa una región específica de la nube electrónica.
- El primer nivel energético (n = 1) es el más cercano al núcleo y puede albergar hasta 2 electrones.
- El segundo nivel energético (n = 2) puede contener hasta 8 electrones.
- El tercer nivel energético (n = 3) puede albergar hasta 18 electrones.
- El cuarto nivel energético (n = 4) puede contener hasta 32 electrones.
- Y así sucesivamente.
Es importante destacar que estos niveles energéticos están subdivididos en subniveles, denominados con letras: s, p, d y f. Cada uno de estos subniveles tiene una forma específica y puede contener un número máximo de electrones. La distribución de los electrones en los subniveles depende de los principios de exclusión de Pauli y el principio de máxima multiplicidad de Hund, que establecen las reglas para llenar los diferentes subniveles y orientaciones espaciales de los electrones.
La influencia de los electrones en las propiedades químicas de los átomos
La distribución de electrones en un átomo determina su configuración electrónica y, por lo tanto, sus propiedades químicas. Los electrones de la capa externa, también conocidos como electrones de valencia, son particularmente importantes, ya que determinan la facilidad con la que un átomo puede formar enlaces químicos con otros átomos.
Los átomos tienden a alcanzar una configuración electrónica estable, en la cual los niveles energéticos más bajos están completos. Esto se logra mediante la ganancia, pérdida o compartición de electrones. Por ejemplo, los átomos con pocos electrones en su capa externa tienden a perderlos para adquirir una carga positiva y formar iones positivos, llamados cationes. Por otro lado, los átomos que tienen casi completa su capa externa tienden a ganar electrones para adquirir una carga negativa y formar iones negativos, llamados aniones.
Además, los electrones de valencia también determinan las propiedades físicas de los elementos, como la conductividad eléctrica y térmica, el punto de fusión y ebullición, y otras características observables.
Las contribuciones fundamentales del modelo cuántico
El modelo cuántico ha permitido explicar fenómenos que no podían ser abordados con los modelos atómicos anteriores. Al ser una teoría cuantitativa, brinda la base matemática para describir con gran precisión el comportamiento de los electrones y su interacción con los núcleos atómicos.
Además, el modelo cuántico ha permitido predicciones más precisas sobre las propiedades y el comportamiento de los átomos y moléculas, ayudando a comprender fenómenos químicos y físicos a nivel atómico y subatómico. Esta nueva comprensión ha impulsado numerosos avances científicos y tecnológicos en campos como la física de partículas, la química cuántica y la electrónica, entre otros.
El modelo cuántico es actualmente el paradigma aceptado para describir la estructura y el comportamiento de la materia a nivel atómico y subatómico. Su desarrollo y aplicación han llevado a una comprensión más profunda de los fundamentos de la realidad y han sentado las bases para importantes avances científicos y tecnológicos.
Cuáles son las principales características del modelo atómico actual
El modelo atómico actual es una representación conceptual de la estructura interna de un átomo. A lo largo de la historia, nuestra comprensión de los átomos ha evolucionado significativamente, y el modelo atómico actual es el resultado de décadas de investigación y experimentación científica.
Una de las principales características de este modelo es que se basa en la teoría cuántica, que describe el comportamiento de las partículas subatómicas y las interacciones entre ellas. Según esta teoría, los electrones no se mueven en órbitas definidas alrededor del núcleo, como se pensaba anteriormente, sino que existen en regiones de probabilidad llamadas orbitales.
Otra característica clave del modelo atómico actual es la idea de los niveles de energía. Los electrones pueden ocupar diferentes niveles de energía alrededor del núcleo, cada uno de los cuales está asociado con una cantidad específica de energía. Estos niveles de energía se representan por medio de los números cuánticos, que describen las propiedades de los electrones, como su posición y spin.
Además, el modelo atómico actual reconoce la existencia de partículas subatómicas más allá de los protones, neutrones y electrones tradicionales. Por ejemplo, se ha descubierto la existencia de quarks, que son las partículas fundamentales que componen los protones y los neutrones, así como de leptones, que incluyen los electrones y neutrinos.
En cuanto a la organización de los electrones, el modelo atómico actual propone la configuración electrónica. Esta es una descripción de cómo se distribuyen los electrones en los diferentes niveles de energía y orbitales alrededor del núcleo. La configuración electrónica determina las propiedades químicas de un átomo y su capacidad para formar enlaces con otros átomos.
El modelo atómico actual es una representación compleja y fascinante de la estructura de la materia. Basado en la teoría cuántica, reconoce la existencia de partículas subatómicas fundamentales y describe la organización de los electrones en niveles de energía y orbitales. El continuo avance científico nos sigue revelando nuevos descubrimientos sobre los secretos de los átomos y cómo interactúan para formar todo lo que nos rodea en el universo.
Cuáles son las partículas subatómicas y cómo se relacionan con el modelo atómico
El modelo atómico actual es el resultado de siglos de investigación científica y descubrimientos en el campo de la física. Este modelo nos ha permitido entender la estructura de la materia a nivel subatómico, revelando los secretos de las partículas que componen los átomos.
En la actualidad, sabemos que los átomos están compuestos por tres partículas subatómicas fundamentales: protones, neutrones y electrones. Estas partículas se encuentran organizadas de manera específica dentro del átomo, formando su estructura básica.
Los protones
Los protones son partículas cargadas positivamente que se encuentran en el núcleo del átomo. Tienen una masa aproximadamente igual a la del neutrón y una carga eléctrica positiva. La cantidad de protones en un átomo determina su número atómico y determina también su identidad química.
Los neutrones
Por otro lado, los neutrones son partículas sin carga eléctrica que también se encuentran en el núcleo del átomo. Tienen una masa similar a la de los protones y su presencia en el núcleo ayuda a mantener estabilidad y control sobre los protones. En algunos átomos, la relación entre protones y neutrones puede variar, dando lugar a diferentes isótopos del mismo elemento químico.
Los electrones
Los electrones son partículas con carga negativa que orbitan alrededor del núcleo en regiones llamadas niveles o capas electrónicas. Estos electrones son los responsables de las interacciones químicas y de la formación de enlaces entre átomos. La cantidad de electrones en un átomo puede variar, lo cual afecta sus propiedades químicas.
Es importante destacar que los electrones no se encuentran distribuidos al azar alrededor del núcleo, sino que siguen un patrón específico definido por los principios de la mecánica cuántica. Esta teoría nos permite entender cómo se organiza y se comporta la materia a nivel subatómico.
- Los niveles o capas electrónicas están numerados del 1 al 7, empezando por el más cercano al núcleo.
- Cada nivel puede contener un número máximo de electrones: el primer nivel tiene capacidad para 2 electrones, el segundo y tercero para 8 electrones, y así sucesivamente.
- Los electrones tienden a ocupar los niveles más cercanos al núcleo antes de llenar los niveles más alejados.
- La distribución de electrones en los niveles electrónicos sigue una regla llamada principio de Aufbau, que establece que los electrones se distribuyen en los orbitales de menor energía primero.
El fascinante modelo atómico actual nos ha permitido comprender los componentes básicos de la materia y cómo se relacionan entre sí. Los protones, neutrones y electrones se organizan de manera precisa dentro del átomo, siguiendo patrones que están determinados por los principios de la mecánica cuántica. Estos descubrimientos revolucionarios nos han ayudado a desentrañar los secretos de la estructura de la materia.
Cómo contribuye el modelo atómico actual a nuestra comprensión de la estructura de la materia
El modelo atómico actual es una teoría fundamental en la física y la química que nos permite comprender la estructura y el comportamiento de la materia a un nivel subatómico. A lo largo de la historia, este modelo ha evolucionado a medida que los científicos han realizado nuevos descubrimientos y han desarrollado experimentos más sofisticados.
En el modelo atómico actual, se considera que los átomos están compuestos por tres partículas fundamentales: protones, neutrones y electrones. Los protones tienen carga positiva, los neutrones son neutros y los electrones tienen carga negativa. Estas partículas se distribuyen en diferentes niveles de energía alrededor de un núcleo central.
Una de las contribuciones más importantes del modelo atómico actual es su capacidad para explicar la estabilidad de los átomos. Según esta teoría, la estabilidad de un átomo depende de su configuración electrónica, es decir, cómo se distribuyen los electrones en los diferentes niveles de energía alrededor del núcleo. Cada nivel de energía puede contener un número máximo de electrones, y cuando los niveles están completamente llenos, el átomo es altamente estable.
Además de las contribuciones en la comprensión de la estabilidad de los átomos, el modelo atómico actual también nos permite entender las interacciones entre diferentes átomos. Por ejemplo, cuando dos átomos se acercan lo suficiente, sus electrones pueden interactuar y formar enlaces químicos. Estos enlaces son cruciales para la formación de moléculas y la creación de sustancias químicas.
El modelo atómico actual también ha sido fundamental en nuestra comprensión de las propiedades de los materiales. Según esta teoría, diferentes elementos químicos tienen diferentes configuraciones electrónicas, lo que resulta en diferentes propiedades como la conductividad eléctrica, la dureza o la capacidad para reaccionar con otros elementos. Gracias a esto, podemos entender por qué algunos materiales son buenos conductores de electricidad mientras que otros no, o por qué algunos metales son más duros que otros.
El modelo atómico actual es una herramienta invaluable en la comprensión de la estructura de la materia. Nos permite entender cómo están compuestos los átomos, cómo interactúan entre sí y cómo estas interacciones dan lugar a diversas propiedades de los materiales. A medida que la ciencia avanza, es probable que nuestro conocimiento del modelo atómico continúe expandiéndose, revelando aún más secretos sobre la naturaleza de la materia.
Cuáles son los avances recientes en el estudio del modelo atómico
En los últimos años, los avances en el estudio del modelo atómico han sido realmente sorprendentes. Los científicos han estado trabajando arduamente para desentrañar los secretos de la estructura de la materia y entender cómo funciona a nivel más fundamental.
Una de las principales áreas de investigación ha sido el desarrollo de microscopios de alta resolución que nos permiten observar los átomos con una precisión sin precedentes. Gracias a estos avances tecnológicos, hemos podido obtener imágenes detalladas de la disposición de los electrones alrededor del núcleo atómico.
Otro avance significativo ha sido la confirmación experimental de la existencia de partículas subatómicas como los quarks y los bosones de Higgs. Estas partículas son fundamentales para comprender cómo se construye la materia y cómo interactúa a nivel subatómico.
Además, se han realizado experimentos que demuestran que los átomos pueden estar en varios estados simultáneamente gracias a un fenómeno llamado superposición cuántica. Esto ha abierto las puertas a nuevas investigaciones sobre la computación cuántica y la posibilidad de crear sistemas mucho más potentes y eficientes que los actuales.
Avances en la teoría del modelo atómico
No solo se han realizado avances en lo experimental, sino también en la teoría que respalda el modelo atómico actual. Los científicos han desarrollado teorías más completas y elegantes para describir la interacción de las partículas subatómicas.
Una de las teorías más destacadas es la teoría cuántica de campos, que describe cómo las partículas elementales interactúan a través de campos cuánticos. Esta teoría ha sido fundamental para explicar fenómenos como la interacción electromagnética y la fuerza nuclear fuerte.
Otro avance teórico importante ha sido la formulación de la teoría de cuerdas, que postula que las partículas subatómicas no son realmente puntos, sino cuerdas que vibran en dimensiones extra. Esta teoría ha abierto nuevas posibilidades para la unificación de las fuerzas fundamentales y la comprensión de la naturaleza del cosmos.
Implicaciones prácticas del estudio del modelo atómico
El estudio del modelo atómico no solo tiene implicaciones teóricas, sino también prácticas. Los avances en este campo han llevado al desarrollo de tecnologías como la nanotecnología y la medicina nuclear.
La nanotecnología se basa en la capacidad de manipular la materia a nivel atómico y molecular. Gracias a estos avances, se han creado materiales mucho más fuertes y livianos, dispositivos electrónicos más pequeños y eficientes, y nuevos métodos de tratamiento de enfermedades, entre muchas otras aplicaciones.
En el caso de la medicina nuclear, se utilizan isótopos radiactivos para diagnosticar y tratar enfermedades. Estos isótopos se generan mediante reacciones nucleares controladas que aprovechan el conocimiento adquirido sobre la estructura atómica y los procesos de desintegración.
Los avances recientes en el estudio del modelo atómico han sido extraordinarios. Nos han permitido ampliar nuestra comprensión de la estructura de la materia y cómo interactúa a nivel más fundamental. Además, estos avances tienen implicaciones significativas en diversos campos, desde la tecnología hasta la medicina. Sin duda, estamos presenciando una época fascinante en el desarrollo de la ciencia y la tecnología.
Cómo se utilizan los conocimientos del modelo atómico en diversas áreas, como la química y la física
El modelo atómico es uno de los pilares fundamentales en la comprensión de la estructura y comportamiento de la materia. Desde su desarrollo en el siglo I, ha sido una herramienta clave en diversas áreas de estudio como la química y la física.
En la química, el modelo atómico nos permite entender cómo los átomos se combinan para formar moléculas y compuestos, así como comprender las reacciones químicas que ocurren a nivel molecular. A través del modelo atómico, podemos determinar la configuración electrónica de los átomos y predecir la estabilidad y las propiedades químicas de los elementos.
En la física, el modelo atómico está vinculado al estudio de la estructura fundamental de la materia, desde partículas subatómicas como protones, neutrones y electrones, hasta sistemas más complejos como átomos, moléculas y materiales. La comprensión de las interacciones y fuerzas entre estas partículas nos permite comprender fenómenos físicos como la conductividad eléctrica, la emisión y absorción de luz, y las propiedades magnéticas de los materiales.
Además de la química y la física, el modelo atómico también tiene aplicaciones en otras disciplinas científicas. En la biología, por ejemplo, el conocimiento del modelo atómico es esencial para entender cómo funcionan las biomoléculas y cómo interactúan con otras sustancias en los organismos vivos. En la medicina, el estudio de las propiedades atómicas y moleculares es crucial para el desarrollo de fármacos y terapias avanzadas.
Cómo se ha desarrollado el modelo atómico a lo largo de la historia
El modelo atómico ha evolucionado a lo largo del tiempo a medida que se han ido descubriendo nuevas evidencias experimentales y desarrollando teorías más complejas. Uno de los primeros modelos fue propuesto por John Dalton en el siglo I, quien postuló que los átomos eran esferas indivisibles e indestructibles.
Sin embargo, a medida que se realizaron experimentos más precisos, surgieron nuevas teorías que complicaron esta visión simplista. J.J. Thomson, por ejemplo, descubrió que los átomos contenían partículas más pequeñas llamadas electrones, lo que llevó a la proposición del modelo de "pastel de pasas" donde los electrones se distribuyen uniformemente en una masa positiva.
Posteriormente, Ernest Rutherford realizó el famoso experimento de la lámina de oro, donde demostró que la mayor parte de la masa y carga positiva del átomo se concentraba en un núcleo central muy pequeño, mientras que los electrones orbitaban alrededor de él. Este descubrimiento llevó al desarrollo del modelo planetario del átomo propuesto por Niels Bohr, en el cual los electrones se encontraban en órbitas discretas alrededor del núcleo.
A partir de entonces, el modelo atómico ha seguido evolucionando con el surgimiento de la mecánica cuántica, que ha proporcionado una descripción más precisa y detallada de la estructura de los átomos y las partículas subatómicas. En este marco teórico, se considera que los electrones no se mueven en órbitas definidas, sino que están localizados en regiones conocidas como orbitales, donde la probabilidad de encontrarlos es mayor.
El desarrollo continuo del modelo atómico ha sido posible gracias a la combinación de experimentos y avances teóricos, permitiendo una comprensión cada vez más profunda de la estructura de la materia. A medida que se descubren nuevas partículas y se realizan descubrimientos en el mundo subatómico, el modelo atómico seguirá evolucionando, proporcionando nuevas perspectivas y avances científicos en diversas áreas del conocimiento.
Qué impacto ha tenido el modelo atómico actual en el desarrollo de nuevas tecnologías
El modelo atómico actual ha sido fundamental en el desarrollo de nuevas tecnologías en diferentes campos de la ciencia y la tecnología. Desde su surgimiento a principios del siglo , este modelo ha revolucionado nuestra comprensión de la estructura de la materia y ha sentado las bases para numerosos avances científicos y tecnológicos.
Una de las principales contribuciones del modelo atómico actual ha sido en el campo de la electrónica. Este modelo nos ha permitido entender cómo los átomos se unen para formar moléculas y materiales, lo que a su vez ha llevado al diseño y creación de dispositivos electrónicos cada vez más pequeños y eficientes. Gracias a la comprensión de cómo los electrones se distribuyen en los átomos, hemos podido desarrollar circuitos integrados más sofisticados y microchips más potentes, dando lugar a computadoras más rápidas y dispositivos móviles más avanzados.
Otro campo en el que el modelo atómico actual ha tenido un impacto significativo es en la física de partículas. Este modelo nos ha permitido entender mejor la estructura interna de los átomos y descubrir partículas subatómicas como los quarks y los leptones. Estos hallazgos han abierto las puertas a investigaciones más profundas sobre las fuerzas fundamentales que rigen el universo, lo que a su vez ha dado lugar a avances en la física teórica y experimental.
Aplicaciones en la medicina y la industria
Además de la electrónica y la física de partículas, el modelo atómico actual también ha tenido un gran impacto en la medicina y la industria. En el campo de la medicina, este modelo ha permitido comprender mejor cómo interactúan los medicamentos con los receptores celulares, lo que ha llevado al diseño de fármacos más eficaces y específicos. También ha sido fundamental en el desarrollo de técnicas de diagnóstico médico como la resonancia magnética y la tomografía computarizada, que se basan en la interacción de los átomos dentro del cuerpo humano.
En la industria, el conocimiento del modelo atómico actual ha sido crucial para el desarrollo de nuevos materiales con propiedades mejoradas. Por ejemplo, la nanotecnología se basa en la manipulación de átomos y moléculas a escala nanométrica para crear materiales con propiedades únicas. Esto ha dado lugar a avances en campos tan diversos como la electrónica, la energía renovable, la medicina y la fabricación de productos químicos.
El futuro del modelo atómico y sus aplicaciones
A medida que avanzamos hacia el futuro, se espera que el modelo atómico siga evolucionando y brindándonos nuevas perspectivas sobre la estructura de la materia. Con herramientas cada vez más sofisticadas, como los aceleradores de partículas y los microscopios de alta resolución, estamos obteniendo imágenes más detalladas e información más precisa sobre los átomos y las partículas subatómicas.
Estas investigaciones podrían llevar a avances revolucionarios en áreas como la computación cuántica, donde se aprovecha la extraña naturaleza de la mecánica cuántica para realizar cálculos mucho más rápidos y complejos que los posibles con los computadores actuales. Además, el modelo atómico actual continúa siendo una herramienta fundamental en la investigación de nuevos materiales con propiedades avanzadas, como materiales superconductores o materiales con capacidades fotovoltaicas mejoradas.
El modelo atómico actual ha tenido un impacto significativo en el desarrollo de nuevas tecnologías en campos como la electrónica, la física de partículas, la medicina y la industria. Continuar investigando y expandiendo nuestro conocimiento sobre la estructura de la materia nos permitirá seguir avanzando y transformando nuestra sociedad en el futuro.
Cuáles son algunas aplicaciones prácticas del modelo atómico en la vida cotidiana
El modelo atómico actual es una teoría que nos permite comprender la estructura básica de la materia y ha sido fundamental para el desarrollo de numerosas aplicaciones prácticas en nuestra vida cotidiana. Estas aplicaciones abarcan diferentes ámbitos, desde la tecnología hasta la medicina, y han revolucionado nuestra forma de vivir y interactuar con el mundo que nos rodea.
Tecnología
En el campo de la tecnología, el modelo atómico ha permitido avances impresionantes. Por ejemplo, gracias a nuestro entendimiento de los electrones y su disposición en los átomos, hemos logrado desarrollar la electrónica y los dispositivos electrónicos que utilizamos todos los días. Desde nuestros teléfonos inteligentes hasta los ordenadores, todos estos dispositivos funcionan gracias a circuitos electrónicos basados en las propiedades del átomo. Además, el conocimiento del modelo atómico también ha llevado al desarrollo de tecnologías como los paneles solares, que aprovechan la capacidad de los átomos para absorber y emitir luz.
Energía nuclear
Otro campo en el que el modelo atómico ha sido fundamental es la energía nuclear. La comprensión de la estructura atómica nos ha permitido desarrollar técnicas para obtener y controlar energía mediante reacciones nucleares. Actualmente, la energía nuclear se utiliza en muchos países como una fuente de energía limpia y eficiente para la generación de electricidad. Sin el conocimiento del modelo atómico, no podríamos haber avanzado en este campo y aprovechar de manera segura esta valiosa fuente de energía.
Medicina
En el campo de la medicina, el modelo atómico tiene aplicaciones importantes en diversas áreas. Por ejemplo, la técnica de la resonancia magnética (MRI) se basa en los principios del modelo atómico para obtener imágenes detalladas del interior del cuerpo humano. Además, el conocimiento de la estructura atómica también es esencial para comprender cómo interactúan los fármacos con nuestro organismo y desarrollar medicamentos más efectivos y seguros.
Química
La química es otra área donde el modelo atómico es fundamental. Este modelo nos permite entender cómo los átomos se combinan entre sí para formar moléculas y sustancias. A partir de esta comprensión, podemos diseñar y sintetizar nuevos materiales con propiedades específicas, como plásticos, vidrios y aleaciones metálicas. Además, el estudio de la estructura atómica nos ayuda a comprender las reacciones químicas y desarrollar productos químicos más eficientes y respetuosos con el medio ambiente.
El modelo atómico actual ha tenido un impacto significativo en nuestra vida cotidiana, gracias a las numerosas aplicaciones prácticas que ha permitido. Desde la tecnología hasta la medicina y la química, este modelo nos ha brindado herramientas fundamentales para comprender y aprovechar la estructura de la materia de una manera sin precedentes. El fascinante mundo del átomo continúa impulsando innovaciones y descubrimientos en todos los aspectos de nuestra sociedad.
Preguntas frecuentes (FAQ)
1. ¿Cuál es el modelo atómico actual?
El modelo atómico actual es el modelo cuántico, que describe los electrones en niveles de energía y las probabilidades de encontrarlos en diferentes ubicaciones dentro del átomo.
2. ¿Qué es la estructura de un átomo?
La estructura de un átomo está compuesta por un núcleo central formado por protones y neutrones, rodeado de electrones que se encuentran en distintos niveles de energía alrededor del núcleo.
3. ¿Cómo se descubrió la existencia de los electrones?
La existencia de los electronestrong> fue descubierta mediante el experimento de la lámina de oro realizado por Ernest Rutherford en 1911, en el que observó que la mayoría de las partículas alfa pasaban directamente a través de la lámina de oro, pero algunas eran desviadas, lo cual indicaba la presencia de una carga negativa en el átomo.
4. ¿Qué son los niveles de energía en un átomo?
Los niveles de energía en un átomo son regiones específicas donde los electrones pueden ser encontrados. Estos niveles están numerados y cada uno puede contener un número máximo de electrones.
5. ¿Cómo se distribuyen los electrones en los átomos?
Los electrones se distribuyen en los átomos siguiendo la regla del llenado de orbitales, que establece que los electrones deben llenar primero los niveles de energía más bajos antes de pasar a niveles de energía superiores.
Entradas relacionadas