Descubre la clave para entenderlo todo: ¿Cuál es la diferencia entre un ácido y una base?
La química es una ciencia fascinante que nos permite comprender la composición y las propiedades de los elementos y compuestos que forman el mundo en el que vivimos. Uno de los conceptos más fundamentales dentro de esta disciplina son los ácidos y las bases, que juegan un papel crucial en muchas reacciones químicas y procesos biológicos.
Exploraremos la diferencia entre los ácidos y las bases, analizando sus propiedades y comportamientos. Examinaremos las diferentes teorías que explican cómo se comportan los ácidos y las bases, y cómo se pueden medir sus niveles de acidez o basicidad. También veremos ejemplos de sustancias ácidas y básicas en la vida cotidiana, y entenderemos por qué es importante comprender estas diferencias para diversas aplicaciones en la medicina, la industria y la ecología.
- Cómo se define un ácido y una base
- Cuáles son las propiedades de los ácidos
- Cuáles son las propiedades de las bases
- Por qué los ácidos y las bases reaccionan entre sí
- Qué es el pH y cómo se relaciona con los ácidos y las bases
- Cuál es la importancia de entender la diferencia entre un ácido y una base en el día a día
- Cuáles son algunos ejemplos comunes de ácidos y bases
- Cuándo es seguro mezclar ácidos y bases
- Qué sucede cuando se neutraliza un ácido con una base
- Existen sustancias que pueden actuar como ácidos y bases al mismo tiempo
- Cómo se puede medir el grado de acidez o basicidad de una sustancia
- Qué beneficios tiene conocer la diferencia entre un ácido y una base en la química y otras disciplinas científicas
- Cuál es la diferencia entre el sabor de un ácido y una base
- Cuál es el papel de los ácidos y las bases en la vida cotidiana
- Preguntas frecuentes (FAQ)
Cómo se define un ácido y una base
Para comprender la diferencia entre un ácido y una base, primero debemos entender cómo se definen cada uno de ellos. Tanto los ácidos como las bases son categorías de sustancias químicas que tienen propiedades específicas y características distintivas.
¿Qué es un ácido?
Un ácido se define como una sustancia química que tiene la capacidad de liberar protones (iones H+) en solución acuosa. En otras palabras, un ácido es capaz de donar iones H+ a otros compuestos o reaccionar con sustancias que pueden aceptar protones. Esta propiedad le confiere al ácido su naturaleza corrosiva, ya que puede atacar y descomponer materiales como metales, tejidos vivos o incluso otras sustancias químicas.
Los ácidos se caracterizan por tener un sabor agrio y la capacidad de cambiar el color de ciertos indicadores, como el tornasol, a tonos rojos o rosados. Además, los ácidos pueden ser identificados por su capacidad para neutralizar bases y formar sales cuando reaccionan con ellas.
¿Y qué es una base?
Una base, por otro lado, se define como una sustancia química que tiene la capacidad de aceptar protones (iones H+) en solución acuosa. Esto significa que una base es capaz de donar pares de electrones libres para combinarlos con iones H+. A diferencia de los ácidos, las bases no tienen la capacidad de liberar iones H+; en cambio, reaccionan con los ácidos para formar agua y sales.
Las bases suelen tener un sabor amargo y una sensación resbaladiza al tacto. También tienen la capacidad de cambiar el color de ciertos indicadores, como la fenolftaleína, a tonos rosados o violetas. Las bases pueden neutralizar ácidos y formar sales cuando reaccionan con ellos.
La principal diferencia entre un ácido y una base radica en su capacidad de donar o aceptar iones H+ en solución acuosa. Mientras que los ácidos liberan protones, las bases los aceptan. Estas diferencias fundamentales en su estructura y comportamiento químico les confieren propiedades distintivas y hacen que desempeñen roles clave en numerosos procesos químicos y biológicos.
Cuáles son las propiedades de los ácidos
Los ácidos son sustancias químicas que se distinguen por sus propiedades características. Estas propiedades juegan un papel fundamental en la comprensión de la diferencia entre un ácido y una base.
Una de las principales propiedades de los ácidos es su capacidad para disociarse en agua y liberar iones de hidrógeno (H+). Esta reacción se conoce como ionización y permite que los ácidos sean conductores de la corriente eléctrica, ya que los iones positivos pueden moverse libremente en el medio acuoso.
Otra propiedad importante de los ácidos es su sabor agrio. Muchos ácidos comunes, como el ácido cítrico presente en los limones o el ácido acético encontrado en el vinagre, tienen un sabor agrio característico. Sin embargo, es importante destacar que no se recomienda probar sustancias ácidas directamente, ya que algunas pueden ser peligrosas o corrosivas para el organismo.
Además del sabor agrio, otro indicador visual de los ácidos es su capacidad para cambiar el color de ciertos pigmentos vegetales. Por ejemplo, al agregar unas gotas de jugo de limón a una solución de repollo morado, esta cambia su color original a rojo, indicando la presencia de un ácido.
Los ácidos también tienen la capacidad de corroer materiales, especialmente metales. En presencia de un ácido fuerte, como el ácido sulfúrico, algunos metales pueden reaccionar y producir gas hidrógeno (H2), junto con sales correspondientes. Esta reacción puede ser evidenciada por la formación de burbujas o efervescencia.
Otra propiedad importante de los ácidos es su capacidad para neutralizar bases. Esta reacción se conoce como una reacción de neutralización y ocurre cuando un ácido y una base se combinan, formando agua y una sal correspondiente. Por ejemplo, la reacción entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH) produce cloruro de sodio (NaCl) y agua (H2O).
Las propiedades de los ácidos incluyen su capacidad para disociarse en agua, su sabor agrio, su capacidad para cambiar el color de ciertos pigmentos vegetales, su capacidad para corroer materiales y su capacidad para neutralizar bases. Estas características distintivas permiten diferenciar los ácidos de otros compuestos químicos y son fundamentales para comprender las propiedades y comportamientos de los ácidos en diversas aplicaciones científicas y prácticas cotidianas.
Cuáles son las propiedades de las bases
Las bases son compuestos químicos que tienen ciertas propiedades distintivas, las cuales nos permiten diferenciarlas de los ácidos. Estas propiedades son fundamentales para entender su comportamiento y sus efectos en diversas reacciones químicas.
Una de las principales características de las bases es su capacidad para aceptar protones o donar pares de electrones. Esta propiedad se conoce como "carácter básico" y está relacionada con la presencia de hidróxido (OH-) en la estructura de la base. Al aceptar un protón, las bases forman moléculas de agua (H2O), mientras que al donar un par de electrones, pueden formar enlaces covalentes con otras especies químicas.
Otra propiedad importante de las bases es su capacidad para neutralizar ácidos. Esto se debe a que, al aceptar protones, las bases pueden eliminar la alta concentración de iones hidronio (H3O+) presentes en una solución ácida. La neutralización entre una base y un ácido produce agua y una sal, lo cual equilibra el pH de la solución y la hace menos corrosiva o más segura para ciertas aplicaciones.
Un aspecto interesante de las bases es su relación con el pH. Si bien los ácidos disminuyen el pH de una solución, las bases, por el contrario, aumentan el pH. Esto se debe a que las bases aumentan la concentración de iones hidroxilo (OH-) en la solución, lo cual reduce la concentración de iones hidronio. De esta manera, las bases contribuyen a la alcalinidad de una solución y pueden ayudar a regular el equilibrio ácido-base en diferentes sistemas biológicos y ambientales.
Es importante destacar que existen diferentes tipos de bases, como las bases inorgánicas y las bases orgánicas. Las bases inorgánicas son aquellas que no contienen carbono en su estructura y se dividen en grupos como hidróxidos metálicos, óxidos básicos y amidas metálicas. Por otro lado, las bases orgánicas están compuestas por átomos de carbono e incluyen compuestos como aminas, alcoholes y amidas orgánicas.
Algunos ejemplos de bases comunes:
- Hidróxido de sodio (NaOH): también conocido como soda cáustica, esta base es ampliamente utilizada en la industria química y en aplicaciones domésticas para fabricar productos de limpieza y desatascar tuberías.
- Hidróxido de calcio (Ca(OH)2): conocido coloquialmente como cal apagada, se utiliza en la construcción y en ciertos procesos industriales, así como en odontología para tratar problemas dentales.
- Amoniaco (NH3): es una base gaseosa utilizada en la producción de fertilizantes, productos de limpieza y en la industria farmacéutica.
- Bicarbonato de sodio (NaHCO3): presente en muchos hogares en forma de polvo blanco, este compuesto es un versátil agente neutralizador utilizado en la cocina, la limpieza, así como en la industria textil y química.
Las bases son compuestos químicos con propiedades únicas que les permiten aceptar protones o donar pares de electrones. Estas sustancias tienen la capacidad de neutralizar ácidos y aumentar el pH de una solución. Además, existen diferentes tipos de bases, tanto inorgánicas como orgánicas, y su uso es amplio en diversas aplicaciones industriales y domésticas.
Por qué los ácidos y las bases reaccionan entre sí
Los ácidos y las bases son dos tipos de sustancias químicas que reaccionan entre sí debido a sus propiedades características. Para entender por qué ocurre esta reacción, es importante comprender las definiciones y comportamientos de cada una de estas sustancias.
Definición de ácido
Un ácido es una sustancia que tiene la capacidad de liberar iones de hidrógeno (H+) cuando se disuelve en agua. Estos iones de hidrógeno hacen que el pH de una solución sea menor a 7. Los ácidos pueden ser fuertes o débiles, dependiendo de su capacidad para liberar iones de hidrógeno. Algunos ejemplos comunes de ácidos incluyen el ácido clorhídrico (HCl), el ácido sulfúrico (H2SO4) y el ácido cítrico (C6H8O7).
Definición de base
Una base es una sustancia que tiene la capacidad de aceptar o capturar iones de hidrógeno (H+) cuando se disuelve en agua. Esto resulta en la formación de iones de hidróxido (OH-) en la solución. Las bases, al contrario de los ácidos, tienen un pH mayor a 7. Algunos ejemplos populares de bases son el hidróxido de sodio (NaOH), el hidróxido de calcio (Ca(OH)2) y el bicarbonato de sodio (NaHCO3).
La diferencia clave entre los ácidos y las bases radica en la naturaleza de los iones que producen cuando se disuelven en agua. Los ácidos liberan iones de hidrógeno, mientras que las bases capturan iones de hidrógeno y generan iones de hidróxido.
Ahora bien, ¿qué sucede cuando un ácido y una base se encuentran en una solución? Cuando estas dos sustancias reaccionan entre sí, ocurre lo que se conoce como una reacción ácido-base o neutralización.
En una reacción ácido-base, los iones de hidrógeno (H+) provenientes del ácido se combinan con los iones de hidróxido (OH-) de la base para formar agua (H2O). Además de la formación de agua, también puede haber la formación de una sal dependiendo de los componentes involucrados en la reacción.
Por ejemplo, si tenemos ácido clorhídrico (HCl), que es un ácido fuerte, y hidróxido de sodio (NaOH), que es una base fuerte, al mezclarlos se produce la siguiente reacción: HCl + NaOH -> H2O + NaCl.
En esta reacción, los iones de hidrógeno procedentes del ácido se combinan con los iones de hidróxido de la base para formar agua, mientras que el sodio del hidróxido de sodio se combina con el cloro del ácido clorhídrico para formar cloruro de sodio (sal común).
Esta reacción ácido-base se caracteriza por ser exotérmica, es decir, libera energía en forma de calor. Por esta razón, a menudo se puede sentir un aumento de la temperatura en la solución resultante.
Los ácidos y las bases reaccionan entre sí debido a sus propiedades químicas. Mientras que los ácidos liberan iones de hidrógeno, las bases aceptan o capturan estos iones. Cuando se mezclan, los iones de hidrógeno del ácido se combinan con los iones de hidróxido de la base para formar agua y posiblemente una sal. Estas reacciones son fundamentales tanto en la química como en muchos procesos biológicos.
Qué es el pH y cómo se relaciona con los ácidos y las bases
El pH es una medida que se utiliza para determinar el grado de acidez o alcalinidad de una sustancia. Se basa en la concentración de iones hidronio (H+) presentes en la solución. En términos simples, el pH indica qué tan ácida o básica es una sustancia y se expresa en una escala numérica que va del 0 al 14.
Un valor de pH por debajo de 7 indica que la sustancia es ácida, mientras que un valor mayor a 7 indica que es básica o alcalina. Un pH neutro corresponde a un valor de 7, lo cual significa que la sustancia no es ni ácida ni básica, sino completamente neutral.
¿Pero cómo se relaciona esto con los ácidos y las bases? Resulta que los ácidos son sustancias capaces de liberar iones de hidrógeno (H+) cuando se disuelven en agua, lo que las hace ácidas. Por otro lado, las bases son sustancias capaces de aceptar iones hidrogeno (H+), lo que las hace alcalinas.
La relación entre los ácidos y las bases y el pH está estrechamente ligada. Cuando un ácido se disuelve en agua, libera iones de hidrógeno, que aumentan la concentración de H+ en la solución, disminuyendo así el pH. Por otro lado, cuando una base se disuelve en agua, acepta iones hidrógeno, lo que disminuye la concentración de H+ y, por ende, aumenta el pH.
Ejemplos de ácidos y bases
Para entender mejor la diferencia entre ácidos y bases, examinemos algunos ejemplos comunes. Un ácido común que todos conocemos es el ácido cítrico, presente en las frutas cítricas como las naranjas y los limones. Cuando exprimimos un limón, por ejemplo, liberamos ácido cítrico en el jugo, lo que le da ese sabor característico y hace que el pH del jugo de limón sea ácido.
Por otro lado, una base comúnmente utilizada es el bicarbonato de sodio, también conocido como bicarbonato de soda. El bicarbonato de sodio tiene propiedades alcalinas y se utiliza para neutralizar ácidos, como cuando lo usamos para aliviar la acidez estomacal.
- Otro ejemplo de ácido es el vinagre, que contiene ácido acético.
- Un ejemplo de base es la leche de magnesia, que contiene hidróxido de magnesio.
- El agua, en su forma pura, es neutra, pero puede actuar como ácido o base dependiendo de las sustancias con las que reaccione.
Ahora que sabemos qué es el pH y cómo se relaciona con ácidos y bases, podemos apreciar mejor la importancia de entender estas diferencias. Nos permite comprender cómo interactúan diferentes sustancias en nuestro entorno, desde los alimentos que consumimos hasta los productos de limpieza que utilizamos en nuestra vida diaria.
Pero recuerda siempre utilizar estos conocimientos con responsabilidad y precaución, ya que algunos ácidos y bases pueden ser peligrosos si no se manejan adecuadamente.
Cuál es la importancia de entender la diferencia entre un ácido y una base en el día a día
La comprensión de la diferencia entre un ácido y una base es crucial en muchos aspectos de nuestra vida cotidiana. Desde la alimentación hasta la limpieza del hogar, estos conceptos desempeñan un papel fundamental en nuestras decisiones diarias.
En primer lugar, entender qué es un ácido y qué es una base nos permite tomar decisiones informadas en lo que respecta a nuestra salud. Por ejemplo, muchas personas sufren de acidez estomacal, que se produce cuando el contenido ácido del estómago regresa al esófago. Saber qué alimentos son más ácidos o alcalinos puede ayudarnos a evitar aquellos que puedan empeorar este problema, favoreciendo así nuestra salud digestiva.
Además, conocer la diferencia entre un ácido y una base puede tener un impacto significativo en nuestra elección de productos de limpieza. Los productos ácidos son excelentes para eliminar manchas difíciles, como las producidas por óxido o mineralización, mientras que los productos alcalinos funcionan mejor para remover grasa y suciedad. Al comprender esta distinción, podemos seleccionar los productos adecuados para cada tarea de limpieza en el hogar, ahorrando tiempo y obteniendo mejores resultados.
Otro aspecto importante donde la diferencia entre ácidos y bases juega un papel importante es en la jardinería y la agricultura. Las plantas tienen diferentes necesidades de pH según sus características y etapas de crecimiento. Al determinar si un suelo es ácido o alcalino, podemos ajustar su pH para proporcionar a las plantas las condiciones óptimas para su desarrollo. Esto nos permite cultivar plantas más sanas y productivas, ya sea en un pequeño jardín o en una gran explotación agrícola.
Como se puede ver, la diferencia entre ácidos y bases es esencial para tomar decisiones informadas en nuestra vida diaria. Desde la alimentación hasta la limpieza del hogar y la jardinería, estos conceptos nos permiten maximizar nuestros resultados y mantenernos saludables. Entender cómo interactúan los ácidos y las bases con nuestro entorno nos proporciona las herramientas necesarias para hacer elecciones inteligentes y equilibradas.
Cuáles son algunos ejemplos comunes de ácidos y bases
Los ácidos y las bases son dos tipos de compuestos químicos que juegan un papel fundamental en nuestra vida diaria. Estos compuestos se encuentran presentes en una amplia variedad de sustancias, desde alimentos y productos de limpieza hasta medicamentos y productos industriales. A continuación, te presentamos algunos ejemplos comunes de ácidos y bases que puedes encontrar en tu hogar o entorno:
Ácidos
Ácido cítrico:Este ácido se encuentra naturalmente en muchas frutas cítricas como naranjas, limones y pomelos. También se utiliza como aditivo alimentario para dar sabor a bebidas y alimentos.Ácido acético:Es el componente principal del vinagre. Se utiliza ampliamente en la cocina y como agente conservante.Ácido clorhídrico:Conocido como el ácido del estómago, se encuentra presente en el jugo gástrico y ayuda en la digestión de los alimentos.Ácido sulfúrico:Es uno de los ácidos más fuertes, utilizado en la producción de fertilizantes, detergentes y explosivos.
Bases
Hidróxido de sodio:También conocido como soda cáustica, se utiliza comúnmente en la fabricación de productos de limpieza y en la industria alimentaria.Hidróxido de calcio:Conocido como cal apagada, es ampliamente utilizado en la construcción y como agente alcalino.Ammonia:Es un compuesto comúnmente utilizado en productos de limpieza y como desodorante.Carbonato de sodio:También conocido como sosa, se utiliza en la fabricación de productos químicos, vidrio y detergentes.
Estos son solo algunos ejemplos de ácidos y bases que se encuentran en diferentes productos y sustancias. La diferencia clave entre los ácidos y las bases radica en su capacidad para donar o aceptar protones (iones H+). Los ácidos son sustancias que liberan protones en una solución acuosa, mientras que las bases aceptan protones en esta misma solución. Esta propiedad determina el comportamiento químico único de los ácidos y las bases y su capacidad para reaccionar con otras sustancias.
Cuándo es seguro mezclar ácidos y bases
La seguridad al mezclar ácidos y bases es un aspecto fundamental en química. El conocimiento de cómo interactúan estos compuestos es clave para evitar accidentes y reacciones peligrosas.
Antes de adentrarnos en el tema de seguridad, es importante entender qué son los ácidos y las bases. Los ácidos son sustancias que liberan iones de hidrógeno (H+) cuando se disuelven en agua. Tienen un sabor agrio y tienen la capacidad de corroer ciertos materiales. Por otro lado, las bases son sustancias que liberan iones hidroxilo (OH-) cuando se disuelven en agua. Tienen un sabor amargo y son resbaladizas al tacto.
Ahora bien, ¿qué sucede cuando mezclamos ácidos y bases? La respuesta está en una reacción química conocida como neutralización. Durante esta reacción, los iones hidrógeno de los ácidos se combinan con los iones hidroxilo de las bases para formar agua (H2O) y una sal.
Es importante tener en cuenta que no todos los ácidos y bases son compatibles entre sí. Algunas combinaciones pueden resultar en reacciones extremadamente exotérmicas, lo que significa que liberan una gran cantidad de calor. Estas reacciones pueden ser peligrosas e incluso provocar explosiones si no se manejan adecuadamente.
Existen ciertas pautas de seguridad que debemos seguir al mezclar ácidos y bases:
- Utilizar guantes, gafas de seguridad y bata de laboratorio para protegerse de posibles salpicaduras.
- Trabajar en un área bien ventilada para evitar la inhalación de vapores tóxicos.
- Mezclar los ácidos y las bases lentamente y en pequeñas cantidades, para controlar la reacción y evitar una liberación excesiva de calor.
- No mezclar ácidos y bases concentrados sin conocimiento previo de las propiedades químicas y la compatibilidad de los compuestos.
Es importante destacar que, aunque algunos ácidos y bases pueden ser seguros de mezclar en condiciones específicas, siempre es recomendable contar con la orientación de un profesional capacitado antes de realizar cualquier experimento o manejo de sustancias químicas.
La seguridad al mezclar ácidos y bases es esencial. Conocer las propiedades de estos compuestos y seguir las pautas de seguridad adecuadas nos permite evitar accidentes y realizar experimentos químicos de manera responsable.
Qué sucede cuando se neutraliza un ácido con una base
Cuando se neutraliza un ácido con una base, ocurre un proceso químico muy interesante. Es importante entender que los ácidos y las bases son dos tipos de compuestos químicos con propiedades opuestas. Los ácidos tienen un sabor agrio y pueden corroer ciertos materiales, mientras que las bases tienen un sabor amargo y pueden sentirse resbaladizas al tacto.
Al mezclar un ácido con una base, se produce lo que se conoce como una reacción de neutralización. Durante esta reacción, los iones hidrógeno (H+) del ácido se combinan con los iones hidroxilo (OH-) de la base para formar agua (H2O). Además, se forma también una sal, que es el resultado de la combinación de los elementos restantes de ambos compuestos.
El equilibrio entre los iones hidrógeno y los iones hidroxilo es crucial para mantener un pH neutral en una solución acuosa. El pH es una medida que indica si una solución es ácida, básica o neutra. Cuando se mezcla un ácido y una base en cantidades estequiométricas, es decir, en la proporción adecuada, se logra neutralizar la solución resultante y obtener un pH neutral de 7.
Es importante destacar que no todos los ácidos y bases tienen las mismas propiedades y características. Algunos ácidos pueden ser más fuertes que otros, lo cual significa que liberan más iones hidrógeno en una solución acuosa. De manera similar, algunas bases pueden ser más fuertes y liberar más iones hidroxilo.
La reacción de neutralización entre un ácido y una base puede tener diferentes aplicaciones en la vida cotidiana. Por ejemplo, es común utilizar bicarbonato de sodio como base para neutralizar el ácido del estómago cuando se tiene acidez estomacal. El bicarbonato de sodio reacciona con el ácido clorhídrico del estómago para formar sal y agua, aliviando así los síntomas de la acidez.
Cuando se neutraliza un ácido con una base, se produce una reacción química en la cual se combinan los iones hidrógeno del ácido con los iones hidroxilo de la base para formar agua y una sal. Esta reacción permite obtener un pH neutral en una solución acuosa. La neutralización ácido-base tiene diversas aplicaciones en la vida cotidiana y es fundamental para entender las propiedades de estos compuestos químicos.
Existen sustancias que pueden actuar como ácidos y bases al mismo tiempo
Los ácidos y las bases son dos tipos de sustancias químicas que juegan un papel fundamental en nuestra vida diaria. En el mundo de la química, son considerados como opuestos: los ácidos tienen propiedades ácidas, mientras que las bases tienen propiedades básicas. Sin embargo, existe una categoría especial de sustancias llamadas anfóteras que pueden comportarse tanto como ácidos como bases, dependiendo del entorno en el que se encuentren.
Esta dualidad de comportamiento es lo que hace que los ácidos y las bases sean tan fascinantes y cruciales para nuestro entendimiento de la química. Para comprender cómo funcionan y cuál es la diferencia entre ellos, debemos adentrarnos en el mundo de los iones y el pH.
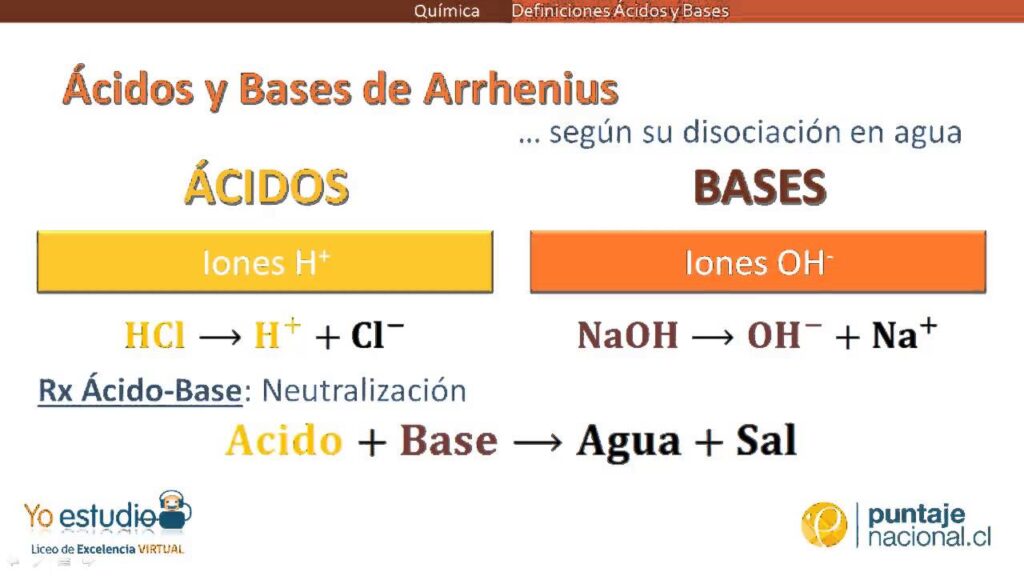
Los ácidos y las bases según la teoría de Arrhenius
Según la teoría de Arrhenius, propuesta por Svante Arrhenius en el siglo I, un ácido es una sustancia capaz de liberar iones de hidrógeno (H+) en solución acuosa. Por otro lado, una base es una sustancia capaz de liberar iones de hidróxido (OH-) en solución acuosa. Esta definición es bastante limitada, ya que solo contempla sustancias que actúan en solución acuosa.
Por ejemplo, el ácido clorhídrico (HCl) se disocia en agua y libera iones de hidrógeno (H+). De manera similar, el hidróxido de sodio (NaOH) también se disocia en agua y libera iones de hidróxido (OH-). Teniendo esto en cuenta, es importante mencionar que el pH de una solución ácida es menor a 7, mientras que el pH de una solución básica es mayor a 7. Una solución neutra tiene un pH de 7.
Los ácidos y las bases según la teoría de Brønsted-Lowry
La teoría de Brønsted-Lowry, propuesta por Johannes Nicolaus Brønsted y Thomas Martin Lowry en 1923, amplía la definición de ácido y base más allá de la disociación en solución acuosa. Según esta teoría, un ácido es una sustancia capaz de donar un protón (H+) y una base es una sustancia capaz de aceptar un protón.
Esta definición más amplia permite que consideremos otras sustancias, como el amoníaco (NH3) y el ion bicarbonato (HCO3-), como bases. En este caso, el amoníaco puede aceptar un protón para formar el ión amonio (NH4+), mientras que el ion bicarbonato puede donar un protón para formar el ion carbonato (CO32-). Esta teoría nos muestra que los ácidos y las bases pueden reaccionar entre sí y formar productos diferentes.
Ácidos y bases anfóteras
Ya hemos mencionado anteriormente que existen ciertas sustancias llamadas anfóteras que pueden actuar tanto como ácidos y bases, dependiendo del entorno en el que se encuentren. Estas sustancias tienen la capacidad de donar o aceptar protones según sea necesario.
Un ejemplo de una sustancia anfótera es el agua (H2O). En solución acuosa pura, el agua puede comportarse como base y aceptar un protón para formar el ion hidróxido (OH-). Sin embargo, también puede comportarse como ácido y donar un protón para formar el ion hidronio (H3O+).
Además del agua, otros ejemplos de sustancias anfóteras son los aminoácidos, los cuales son los componentes básicos de las proteínas. Los aminoácidos tienen grupos funcionales que pueden actuar como ácidos o bases, dependiendo del entorno en el que se encuentren.
Los ácidos y las bases son sustancias químicas con propiedades opuestas que desempeñan un papel crucial en nuestra comprensión de la química. Los ácidos pueden liberar iones de hidrógeno (H+) o donar protones, mientras que las bases pueden liberar iones de hidróxido (OH-) o aceptar protones.
Es importante tener en cuenta que, aunque existen definiciones clásicas para los ácidos y las bases, hay sustancias que pueden comportarse como ambos, conocidas como anfóteras. Estas sustancias tienen la capacidad de donar o aceptar protones según sea necesario.
El estudio de los ácidos y las bases nos ayuda a comprender procesos químicos fundamentales, como la neutralización, las reacciones redox y la formación de sales. Su importancia se extiende más allá del laboratorio y se refleja en nuestro día a día, desde la digestión en nuestro sistema gastrointestinal hasta el cuidado de nuestras piscinas.
Cómo se puede medir el grado de acidez o basicidad de una sustancia
La medición del grado de acidez o basicidad de una sustancia es esencial para comprender las propiedades químicas y su comportamiento en diferentes entornos. En química, se utiliza un parámetro conocido como el pH (potencial de hidrógeno) para determinar si una sustancia es ácida o básica.
El pH es una escala numérica que va del 0 al 14 y se basa en la concentración de iones hidronio (H3O+) presentes en una solución. Un valor de pH menor a 7 indica que una sustancia es ácida, mientras que un valor mayor a 7 indica que es básica. Un pH de 7 corresponde a una sustancia neutra.
Existen diferentes métodos para medir el pH de una sustancia. Uno de los más comunes es el uso de papeles indicadores, que son tiras impregnadas con sustancias químicas sensibles al pH. Al sumergir la tira en la sustancia a analizar, esta cambia de color y permite determinar si es ácida, básica o neutra.
Otro método ampliamente utilizado es el uso de pHmetros, que son dispositivos electrónicos diseñados específicamente para medir el pH. Estos instrumentos utilizan electrodos selectivos que generan una señal eléctrica proporcional al pH de la solución. La lectura se muestra en una pantalla digital.
Es importante destacar que además del pH, existen otros parámetros que pueden ser utilizados para medir la acidez o basicidad de una sustancia. Por ejemplo, la concentración de iones hidrógeno (H+) o la concentración de hidróxido (OH-) pueden ser empleadas para determinar el grado de acidez o basicidad según sea el caso.
La medición del grado de acidez o basicidad de una sustancia es fundamental en química. El pH es el parámetro más utilizado, pero existen diferentes métodos y técnicas para llevar a cabo esta medición. Ya sea utilizando papeles indicadores o pHmetros, es posible determinar con precisión si una sustancia es ácida, básica o neutra.
Qué beneficios tiene conocer la diferencia entre un ácido y una base en la química y otras disciplinas científicas
La diferencia entre un ácido y una base es un concepto fundamental en química y otras disciplinas científicas. Comprender esta distinción es esencial para avanzar en el estudio de la química, así como en diversas áreas como la biología, la medicina y la tecnología de materiales.
Conocer la diferencia entre un ácido y una base permite entender cómo se producen muchas reacciones químicas en los sistemas biológicos y naturales. Los ácidos y las bases están presentes en nuestro entorno diario, desde los alimentos que consumimos hasta los productos de limpieza que utilizamos.
El papel de los ácidos y las bases en las reacciones químicas
Los ácidos y las bases son compuestos químicos que pueden ionizarse en solución acuosa, liberando iones H+ y OH- respectivamente. Esta capacidad de ionización es lo que determina su comportamiento y sus propiedades químicas características.
En una reacción ácido-base, el ácido dona protones (H+) a la base, que los acepta. Esto resulta en la formación de un producto iónico y agua. Esta reacción se conoce como neutralización y es fundamental para equilibrar el pH en los sistemas biológicos y mantener el funcionamiento adecuado de muchos procesos fisiológicos.
Las propiedades ácido-base también influyen en la solubilidad y la capacidad tamponadora de las sustancias. Un ácido fuerte, por ejemplo, puede ser corrosivo y tener un impacto negativo en los tejidos vivos. Por otro lado, una base fuerte puede ser altamente alcalina y causar quemaduras en la piel.
Aplicaciones prácticas de los ácidos y las bases
El conocimiento de la diferencia entre un ácido y una base es fundamental en muchas aplicaciones prácticas. En la industria alimentaria, por ejemplo, los ácidos se utilizan como conservantes y para mejorar el sabor de los alimentos. Las bases, por otro lado, pueden ser utilizadas para ajustar el pH en la producción de bebidas y productos lácteos.
En la medicina, el equilibrio ácido-base en el cuerpo es crucial para mantener la homeostasis y prevenir enfermedades. Los desequilibrios en el pH sanguíneo, por ejemplo, pueden indicar un mal funcionamiento de los órganos o sistemas del cuerpo. El conocimiento de los ácidos y las bases también es importante en la farmacología, ya que muchos medicamentos interactúan con diferentes niveles de acidez y basicidad en el organismo.
Comprender la diferencia entre un ácido y una base es esencial en diversas disciplinas científicas. Esta distinción nos permite entender el comportamiento químico de sustancias y su papel en reacciones biológicas y naturales. Además, tiene aplicaciones prácticas en la industria y en la medicina. Por lo tanto, familiarizarse con estos conceptos básicos es clave para avanzar en el estudio y la comprensión de la química y otras áreas relacionadas.
Cuál es la diferencia entre el sabor de un ácido y una base
Cuando se trata de la diferencia entre un ácido y una base, uno de los aspectos más evidentes es su sabor. Mientras que los ácidos suelen tener un sabor agrio o amargo, las bases tienden a ser amargas o incluso dulces en algunos casos.
Este contraste en el sabor se debe a las diferentes estructuras químicas de los ácidos y las bases. Los ácidos son compuestos capaces de donar protones (iones H+) cuando se disuelven en agua, lo que resulta en un pH menor a 7. Por otro lado, las bases son compuestos capaces de aceptar protones o donar iones hidróxido (OH-) cuando se disuelven en agua, lo que resulta en un pH mayor a 7.
Una forma de entender esta diferencia en el sabor es pensar en cómo reaccionan estas sustancias con nuestros papilas gustativas. Cuando consumimos un ácido, los protones liberados interactúan con los receptores del gusto en nuestra lengua, creando sensaciones de acidez y amargura. En cambio, las bases pueden interactuar con estos mismos receptores de diferentes maneras, dando lugar a sensaciones amargas o incluso dulces.
Sin embargo, es importante destacar que no todos los ácidos y bases tienen el mismo sabor. Algunos ácidos, como el vinagre, pueden tener un sabor agrio intenso, mientras que otros pueden ser menos notorios. De manera similar, algunas bases, como el bicarbonato de sodio, pueden tener un sabor amargo característico, pero otras pueden ser más sutiles.
Además del sabor, también existen otras diferencias importantes entre los ácidos y las bases. Por ejemplo, los ácidos tienen la capacidad de corroer materiales, como metales, debido a su reactividad. Las bases, por otro lado, tienen propiedades alcalinas y pueden neutralizar los ácidos.
La diferencia en el sabor entre los ácidos y las bases está determinada por su composición química y sus efectos en nuestras papilas gustativas. Los ácidos tienden a ser agrios o amargos, mientras que las bases pueden ser amargas o incluso dulces. Sin embargo, es importante recordar que no todos los ácidos y bases tienen el mismo sabor, y existen otras diferencias clave entre ellas en términos de reactividad y propiedades químicas.
Cuál es el papel de los ácidos y las bases en la vida cotidiana
Los ácidos y las bases son dos sustancias químicas que desempeñan un papel crucial en nuestra vida cotidiana. Aunque a primera vista pueden parecer términos complejos y abstractos, entender la diferencia entre un ácido y una base es fundamental para comprender muchos procesos químicos que ocurren a nuestro alrededor.
Para empezar, debemos tener en cuenta que tanto los ácidos como las bases son compuestos químicos que se disocian en agua y pueden liberar iones de hidrógeno (H+) o hidroxilo (OH-) respectivamente. Esta capacidad para liberar iones es lo que les confiere sus propiedades características.
Propiedades de los ácidos
Los ácidos son sustancias que tienden a tener un sabor agrio y su presencia puede ser detectada fácilmente en muchos alimentos comunes, como el limón o el vinagre. Además, los ácidos tienen la capacidad de corroer metales, causar quemaduras en la piel y hacer que ciertos materiales se disuelvan.
En cuanto a su comportamiento químico, los ácidos tienen la capacidad de donar protones (iones H+) a otras sustancias. Al hacerlo, cambian el pH de la solución hacia un valor menor a 7, lo que indica una mayor concentración de iones de hidrógeno.
Propiedades de las bases
Por otro lado, las bases son sustancias que tienden a tener un sabor amargo y resbaladizo al tacto. Algunos ejemplos claros de bases son el bicarbonato de sodio y la lejía. Estas sustancias son consideradas básicas debido a su capacidad para aceptar protones (iones H+) o donar iones hidroxilo (OH-).
Las bases tienen la particularidad de elevar el pH de una solución, es decir, incrementar la concentración de iones hidroxilo (OH-) y disminuir la concentración de iones de hidrógeno. Esto hace que las soluciones básicas tengan un pH superior a 7.
Tanto los ácidos como las bases son compuestos químicos con propiedades distintivas y que desempeñan un papel fundamental en nuestra vida diaria. Su presencia e interacción están presentes en diversos procesos, desde la digestión de los alimentos hasta el funcionamiento de nuestras células. Por lo tanto, entender la diferencia entre un ácido y una base nos permite comprender mejor cómo interactúan estas sustancias en nuestro entorno y cómo podemos aprovechar sus propiedades en diferentes situaciones.
Preguntas frecuentes (FAQ)
1. ¿Qué es un ácido?
Un ácido es una sustancia que puede liberar iones hidrógeno (H+) en solución acuosa.
2. ¿Qué es una base?
Una base es una sustancia que puede aceptar iones hidróxido (OH-) en solución acuosa.
3. ¿Cuál es la diferencia entre un ácido y una base?
La principal diferencia entre un ácido y una base es que los ácidos donan iones H+ mientras que las bases aceptan iones OH-.
4. ¿Cómo se mide la acidez y la basicidad de una sustancia?
La acidez y basicidad se pueden medir utilizando el pH, que es una escala que va desde 0 (muy ácido) hasta 14 (muy básico), siendo 7 el pH neutro.
5. ¿Cuáles son algunos ejemplos comunes de ácidos y bases?
Algunos ejemplos comunes de ácidos incluyen el ácido clorhídrico, el ácido sulfúrico y el ácido cítrico. Algunos ejemplos de bases son el hidróxido de sodio, el hidróxido de calcio y el hidróxido de amonio.
Deja una respuesta
Entradas relacionadas