¡Descubre cuántos moles hay en 30 g de H2SO4 y domina las conversiones químicas al instante!
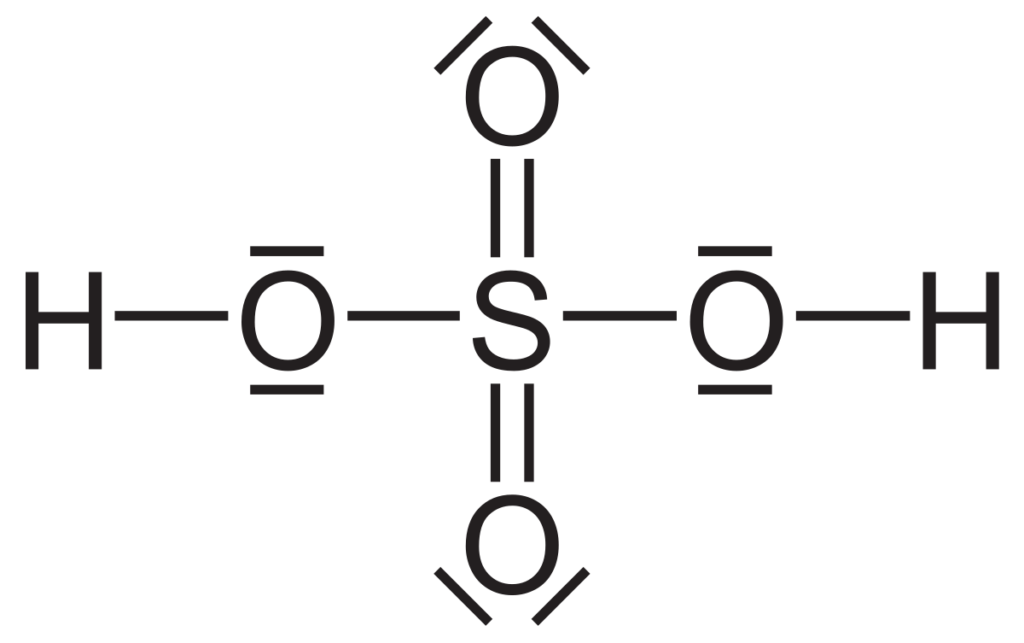
La cantidad de sustancias químicas que se utilizan en los laboratorios y en la industria se mide normalmente en moles. Un mol es una unidad que representa la cantidad de sustancia igual a la cantidad de átomos presentes en exactamente 12 gramos de carbono-12. La conversión entre masa y moles es una habilidad esencial en química, ya que permite determinar la cantidad de reactivo necesaria para llevar a cabo una reacción química o calcular la masa de un producto obtenido.
Descubrirás cómo realizar conversiones de masa a moles y viceversa, utilizando el ejemplo específico del ácido sulfúrico (H2SO4). Veremos paso a paso cómo calcular cuántos moles hay en una determinada masa de H2SO4 y también cómo calcular la masa correspondiente a una cantidad dada de moles. Además, te proporcionaremos algunos consejos y trucos útiles para hacer las conversiones de manera rápida y efectiva. ¡Prepárate para dominar las conversiones químicas al instante!
- Cómo calcular la cantidad de moles en 30 g de H2SO4
- Cuáles son las Conversiones Químicas y por qué son importantes
- Cuál es la fórmula para calcular los moles a partir de la masa
- Qué datos necesito para realizar la conversión de masa a moles
- Cuál es la masa molar del H2SO4
- Cuál es la relación entre los gramos y los moles en una sustancia química
- Cuál es la ecuación a utilizar para realizar la conversión de masa a moles
- Cómo se realiza el cálculo paso a paso para determinar los moles en 30 g de H2SO4
- Qué otras conversiones químicas se pueden realizar con esta misma fórmula
- Por qué es importante dominar las conversiones químicas en la química
- Preguntas frecuentes (FAQ)
Cómo calcular la cantidad de moles en 30 g de H2SO4
El cálculo de la cantidad de moles en una determinada masa de H2SO4 es esencial para poder realizar conversiones químicas precisas y eficientes. Los moles son una unidad de medida utilizada en química para representar la cantidad de sustancia presente en una muestra.
Para calcular la cantidad de moles en 30 g de H2SO4, debemos conocer la masa molar de esta sustancia. La masa molar se define como la masa de un mol de cualquier sustancia, expresada en gramos. En el caso del ácido sulfúrico (H2SO4), su masa molar es de aproximadamente 98 gramos por mol.
Una vez que tenemos la masa molar, podemos utilizar la fórmula matemática para calcular los moles. La fórmula es:
Moles = Masa / Masa molar
Aplicando la fórmula a nuestro ejemplo, sustituimos los valores conocidos:
Moles = 30 g / 98 g/mol
Realizando la operación, obtenemos:
Moles ≈ 0.31 mol
Por lo tanto, en 30 g de H2SO4 hay aproximadamente 0.31 moles.
Es importante destacar que este cálculo se basa en la masa molar promedio de una sustancia y puede variar ligeramente según las condiciones específicas del compuesto. Además, es fundamental recordar que los moles son una unidad de medida relativa y se utilizan para realizar conversiones entre diferentes sustancias químicas. Esta habilidad es de vital importancia en química y nos permite trabajar con cantidades precisas y comparar diferentes sustancias de manera equitativa.
Cuáles son las Conversiones Químicas y por qué son importantes
Las conversiones químicas son un concepto fundamental en la química y son clave para comprender y resolver problemas relacionados con las cantidades de sustancias involucradas en una reacción química. Estas conversiones permiten transformar unidades de una sustancia a otra utilizando relaciones estequiométricas basadas en las proporciones molares dadas por una ecuación química balanceada.
Cuando se estudian reacciones químicas, es importante poder relacionar las cantidades de los reactivos y productos involucrados. Para ello, se utilizan las relaciones molares presentes en la ecuación química balanceada de la reacción. Estas relaciones nos indican las proporciones en las que las sustancias reaccionan entre sí y se convierten en nuevos productos.
En el caso de las conversiones químicas, es necesario utilizar las relaciones molares para convertir las cantidades de una sustancia a otra. Esto implica utilizar factores de conversión que relacionen las masas molares de las sustancias y las proporciones molares de la reacción. De esta manera, podemos determinar la cantidad de una sustancia necesaria o producida en una reacción química.
Cálculo del número de moles
Un concepto clave en las conversiones químicas es el número de moles. El mol es la unidad de cantidad de sustancia en el Sistema Internacional de Unidades (SI) y nos permite contar la cantidad de átomos, moléculas o iones en una muestra determinada.
Para calcular el número de moles en una muestra, es necesario conocer la masa de la sustancia y su masa molar. La masa molar se expresa en gramos por mol (g/mol) y representa la masa de un mol de átomos, moléculas o iones.
Supongamos que tenemos una muestra de ácido sulfúrico (H2SO4) con una masa de 30 gramos. Para determinar el número de moles en esta muestra, utilizamos la masa molar del ácido sulfúrico que es aproximadamente 98 g/mol.
Número de moles = Masa / Masa molarNúmero de moles = 30 g / 98 g/mol ≈ 0.306 moles
Por lo tanto, en 30 gramos de ácido sulfúrico, hay aproximadamente 0.306 moles de H2SO4.
- El número de moles es una cantidad importante en química ya que nos permite relacionar las masas de distintas sustancias y realizar conversiones entre ellas.
- Es necesario utilizar las relaciones molares presentes en las ecuaciones químicas balanceadas para realizar conversiones químicas adecuadas.
- Conocer el número de moles en una muestra nos ayuda a determinar la cantidad de sustancia presente y realizar cálculos estequiométricos.
Cuál es la fórmula para calcular los moles a partir de la masa
Para calcular los moles a partir de la masa de una sustancia, necesitamos conocer la fórmula y el peso molecular de la misma. En este caso, vamos a utilizar el ácido sulfúrico (H2SO4) como ejemplo.
Paso 1: Conocer el peso molecular
El peso molecular del ácido sulfúrico se calcula sumando las masas atómicas de todos los elementos que lo componen. En este caso, tenemos dos átomos de hidrógeno (H), un átomo de azufre (S) y cuatro átomos de oxígeno (O). Las masas atómicas de estos elementos son:
- Hidrógeno (H): 1 g/mol
- Azufre (S): 32 g/mol
- Oxígeno (O): 16 g/mol
Entonces, el peso molecular del ácido sulfúrico se calcula así:
(2 * 1 g/mol) + (1 * 32 g/mol) + (4 * 16 g/mol) = 98 g/mol
Por lo tanto, el peso molecular del ácido sulfúrico es de 98 g/mol.
Paso 2: Calcular los moles
Una vez que conocemos el peso molecular del ácido sulfúrico, podemos utilizar la siguiente fórmula para calcular los moles a partir de la masa:
moles = masa / peso molecular
En nuestro caso, queremos calcular los moles a partir de una masa de 30 g de ácido sulfúrico:
moles = 30 g / 98 g/mol ≈ 0.306 moles
Por lo tanto, hay aproximadamente 0.306 moles de ácido sulfúrico en 30 g.
Entender cómo calcular los moles a partir de la masa es fundamental en química. Con la fórmula adecuada y el conocimiento del peso molecular, podemos realizar conversiones químicas con facilidad. Recuerda que esta fórmula se puede aplicar a cualquier sustancia, siempre y cuando conozcas su peso molecular. ¡Ahora estás listo para dominar las conversiones químicas al instante!
Qué datos necesito para realizar la conversión de masa a moles
Para realizar la conversión de masa a moles en una sustancia química, es importante contar con ciertos datos clave. En primer lugar, necesitamos conocer la masa de la sustancia que queremos convertir. En este caso, tenemos 30 gramos de H2SO4.
Además de la masa, también debemos tener en cuenta la masa molar o peso molecular de la sustancia en cuestión. La masa molar representa la masa de un mol de esa sustancia y se expresa en gramos/mol. En el caso del ácido sulfúrico (H2SO4), su masa molar es de aproximadamente 98 g/mol.
Una vez que contamos con estos dos datos fundamentales, podemos proceder a realizar la conversión utilizando la siguiente fórmula:
Número de moles = Masa / Masa molar
En nuestro caso, sustituyendo los valores correspondientes, tenemos:
Número de moles = 30 g / 98 g/mol
Realizando la división, obtenemos el número de moles de ácido sulfúrico contenido en los 30 gramos dados.
Cómo realizar la conversión de masa a moles paso a paso
- Escribe la fórmula genérica para la conversión de masa a moles:
Número de moles = Masa / Masa molar. - Identifica la masa de la sustancia que deseas convertir. En este caso, 30 gramos de H2SO4.
- Consulta la masa molar del compuesto. Para el H2SO4, es de aproximadamente 98 g/mol.
- Sustituye los valores en la fórmula:
Número de moles = 30 g / 98 g/mol. - Realiza la división para obtener el resultado. En este ejemplo, obtendrás el número de moles de ácido sulfúrico contenido en los 30 gramos dados.
Recuerda que cada sustancia tiene una masa molar específica y que esta puede ser utilizada para realizar conversiones entre masa y moles. Dominar estas conversiones te permitirá comprender mejor las cantidades de sustancias involucradas en las reacciones químicas y realizar cálculos precisos en el laboratorio.
Cuál es la masa molar del H2SO4
Para poder calcular cuántos moles hay en 30 g de H2SO4, primero necesitamos saber cuál es la masa molar de esta sustancia. La masa molar se refiere a la masa de un mol de partículas de una sustancia en gramos.
En el caso del ácido sulfúrico (H2SO4), tenemos 2 átomos de hidrógeno (H), 1 átomo de azufre (S) y 4 átomos de oxígeno (O). Para determinar la masa molar, debemos sumar las masas atómicas de cada uno de estos elementos multiplicadas por su respectivo subíndice.
La masa atómica del hidrógeno es de aproximadamente 1 g/mol, mientras que la masa atómica del azufre es de alrededor de 32 g/mol y la del oxígeno es de aproximadamente 16 g/mol.
Por lo tanto, podemos calcular la masa molar del ácido sulfúrico de la siguiente manera:
Masa molar (H2SO4) = 2(1 g/mol) + 1(32 g/mol) + 4(16 g/mol)Masa molar (H2SO4) = 2 g/mol + 32 g/mol + 64 g/molMasa molar (H2SO4) = 98 g/mol
Entonces, la masa molar del ácido sulfúrico es de 98 g/mol.
Cómo calcular los moles en 30 g de H2SO4
Una vez que conocemos la masa molar del ácido sulfúrico, podemos utilizarla para calcular cuántos moles hay en 30 g de H2SO4.
Para hacer esto, usamos la fórmula:
Moles = Masa (g) / Masa molar (g/mol)
Sustituyendo los valores conocidos:
Moles = 30 g / 98 g/mol
Calculando esta expresión, obtenemos:
Moles ≈ 0.306 moles
Por lo tanto, hay aproximadamente 0.306 moles de H2SO4 en 30 g de esta sustancia.
Conocer la cantidad de moles en una cantidad dada de una sustancia es fundamental en química, ya que nos permite realizar conversiones entre diferentes unidades y realizar cálculos precisos.
Es importante recordar que este cálculo se basa en la masa molar promedio de los elementos, por lo que los resultados pueden variar ligeramente en función de la precisión de las masas atómicas utilizadas. Sin embargo, para muchos propósitos, esta aproximación es suficientemente precisa.
Cuál es la relación entre los gramos y los moles en una sustancia química
Para comprender la relación entre los gramos y los moles en una sustancia química, es importante entender primero qué son los moles. En química, un mol es una unidad de medida utilizada para representar una cantidad específica de átomos, moléculas o iones.
¿Qué es un mol?
Un mol se define como la cantidad de sustancia que contiene tantas entidades elementales como átomos hay en exactamente 12 gramos de carbono-12. Esta definición establece una base para comparar la cantidad de sustancia entre diferentes elementos y compuestos químicos.
Un mol equivale a aproximadamente 6.022 x 10^23 entidades elementales, lo cual se conoce como el número de Avogadro. Este número se utiliza para realizar conversiones entre moles y otras unidades de medida, como gramos.
La relación entre los gramos y los moles en una sustancia química está determinada por la masa molar de dicha sustancia. La masa molar se refiere a la masa de un mol de esa sustancia en gramos. Por ejemplo, la masa molar del dióxido de carbono (CO2) es de aproximadamente 44 gramos por mol.
Cómo calcular los moles a partir de los gramos
moles = gramos / masa molar
Para convertir los gramos a moles, se divide la masa dada entre la masa molar de la sustancia. Por ejemplo, si queremos averiguar cuántos moles hay en 30 gramos de ácido sulfúrico (H2SO4), necesitamos conocer su masa molar.
masa molar de H2SO4 = (2 * masa atómica de H) + (1 * masa atómica de S) + (4 * masa atómica de O)
La masa atómica del hidrógeno (H) es aproximadamente 1 gramo por mol, la del azufre (S) es de aproximadamente 32 gramos por mol y la del oxígeno (O) es de aproximadamente 16 gramos por mol. Realizando los cálculos:
masa molar de H2SO4 = (2 * 1 g/mol) + (1 * 32 g/mol) + (4 * 16 g/mol) = 98 g/mol
Una vez que conocemos la masa molar de H2SO4, podemos calcular los moles utilizando la fórmula mencionada anteriormente:
moles de H2SO4 = 30 g / 98 g/mol ≈ 0.306 moles
Conversión de moles a gramos
Del mismo modo, también es posible realizar la conversión inversa, es decir, convertir moles en gramos. Para ello, se multiplica la cantidad de moles por la masa molar de la sustancia.
gramos = moles * masa molar
Siguiendo con el ejemplo anterior, si tenemos 0.306 moles de H2SO4 y queremos saber cuántos gramos son:
gramos de H2SO4 = 0.306 moles * 98 g/mol ≈ 30 g
Como podemos observar, la conversión entre gramos y moles en una sustancia química se realiza utilizando la masa molar de la misma. Esta relación es fundamental para comprender y realizar cálculos en química, ya que nos permite determinar la cantidad de sustancia presente en una muestra dada.
Cuál es la ecuación a utilizar para realizar la conversión de masa a moles
Cuál es la ecuación a utilizar para realizar la conversión de masa a moles
La conversión de masa a moles es un cálculo esencial en química que nos permite determinar la cantidad de sustancia en una muestra. Esta conversión se basa en la relación entre la masa y la masa molar de una sustancia, expresada en gramos/moles.
Para llevar a cabo esta conversión, utilizamos la siguiente fórmula:
moles = masa / masa molar
Donde "masa" representa la cantidad de sustancia en gramos y "masa molar" es la masa de un mol de esa sustancia en gramos/mol. Al dividir la masa entre la masa molar, obtendremos la cantidad de moles presentes.
En el caso específico del ácido sulfúrico (H2SO4), tenemos que su masa molar es igual a 98.09 g/mol. Si deseamos determinar cuántos moles hay en 30 g de H2SO4, simplemente debemos aplicar la fórmula mencionada anteriormente:
moles de H2SO4 = masa / masa molar
Sustituyendo los valores conocidos:
moles de H2SO4 = 30 g / 98.09 g/mol
Realizando la división:
moles de H2SO4 ≈ 0.306 mol
Por lo tanto, en 30 g de ácido sulfúrico (H2SO4) hay aproximadamente 0.306 moles.
Cómo se realiza el cálculo paso a paso para determinar los moles en 30 g de H2SO4
En el mundo de la química, una de las habilidades esenciales es poder realizar conversiones entre diferentes unidades. En este caso, nos enfocaremos en cómo determinar los moles en una cantidad dada de una sustancia. Tomemos como ejemplo el ácido sulfúrico (H2SO4) y supongamos que se nos ha dado una muestra de 30 g de esta sustancia.
Para comenzar, necesitamos conocer la masa molar del H2SO4, es decir, la masa molecular de la sustancia expresada en gramos por mol. Al observar la tabla periódica, vemos que la masa atómica del hidrógeno (H) es aproximadamente 1 g/mol, la masa atómica del azufre (S) es aproximadamente 32 g/mol y la masa atómica del oxígeno (O) es aproximadamente 16 g/mol.
Ahora, debemos considerar cuántos átomos de cada elemento hay en una molécula de H2SO4. Como su fórmula química indica, hay 2 átomos de hidrógeno, 1 átomo de azufre y 4 átomos de oxígeno en una molécula de H2SO4.
Para calcular la masa molar del H2SO4, multiplicamos las masas atómicas de cada elemento por el número de átomos presentes y luego sumamos los resultados. En este caso, sería:
(2 * 1 g/mol) + (1 * 32 g/mol) + (4 * 16 g/mol)
Realizando los cálculos obtenemos:
(2 g/mol) + (32 g/mol) + (64 g/mol) = 98 g/mol
Entonces, la masa molar del H2SO4 es de aproximadamente 98 g/mol.
Ahora que conocemos la masa molar, podemos utilizarla para realizar la conversión de los gramos de H2SO4 a moles. Para hacer esto, dividimos la masa dada (30 g) por la masa molar (98 g/mol) y obtenemos el número de moles:
número de moles = masa dada / masa molarnúmero de moles = 30 g / 98 g/mol
Haciendo la división, calculamos:
número de moles ≈ 0.306 mol
Por lo tanto, hay aproximadamente 0.306 moles en 30 g de H2SO4.
La capacidad de convertir entre unidades es crucial en química, ya que nos permite relacionar cantidades de una sustancia con diferentes contextos y situaciones. Ahora que has dominado cómo obtener el número de moles a partir de una cantidad dada de una sustancia, ¡estás un paso más cerca de convertirte en un experto en conversiones químicas!
Qué otras conversiones químicas se pueden realizar con esta misma fórmula
Además de la conversión de masa a moles, el ácido sulfúrico (H2SO4) puede participar en una variedad de conversiones químicas. Estas conversiones se basan en las propiedades del compuesto y permiten relacionar el ácido sulfúrico con otras sustancias.
Convertir moles de H2SO4 a moles de otro compuesto
Una manera común de utilizar el ácido sulfúrico en conversiones químicas es transformando sus moles en los moles de otra sustancia. Para ello, primero necesitamos conocer la estequiometría de la reacción y equilibrarla adecuadamente. Luego, utilizamos la proporción entre los coeficientes estequiométricos de ambas sustancias para calcular la cantidad de moles del otro compuesto.
Ejemplo:
Consideremos la reacción entre el ácido sulfúrico y el hidróxido de sodio (NaOH):
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
Supongamos que tenemos 5 moles de H2SO4. Para determinar cuántos moles de NaOH se necesitan para reaccionar con estos 5 moles de ácido sulfúrico, utilizamos la proporción de los coeficientes estequiométricos:
(5 moles H2SO4) x (2 moles NaOH / 1 mol H2SO4) = 10 moles NaOH
Por lo tanto, se necesitan 10 moles de NaOH para reaccionar por completo con 5 moles de H2SO4.
Convertir moles de otro compuesto a moles de H2SO4
Al igual que convertimos moles de H2SO4 a moles de otro compuesto, también es posible realizar el proceso inverso. Para esto, seguimos el mismo enfoque estequiométrico, pero esta vez utilizamos la proporción inversa entre los coeficientes estequiométricos.
Ejemplo:
Consideremos la misma reacción anterior entre el ácido sulfúrico y el hidróxido de sodio:
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
Supongamos que tenemos 15 moles de NaOH y queremos determinar cuántos moles de H2SO4 serían necesarios para reaccionar completamente con estos moles de hidróxido de sodio. Utilizando la proporción inversa:
(15 moles NaOH) x (1 mol H2SO4 / 2 moles NaOH) = 7.5 moles H2SO4
Por lo tanto, se necesitarían 7.5 moles de H2SO4 para reaccionar completamente con 15 moles de NaOH.
Otras conversiones relacionadas con el ácido sulfúrico
Además de las conversiones mencionadas anteriormente, el ácido sulfúrico también puede participar en otras reacciones químicas y conversiones. Algunas de estas incluyen:
- Conversión entre gramos de H2SO4 y volumen de solución acuosa de ácido sulfúrico
- Conversión entre moles de H2SO4 y volumen de solución acuosa de ácido sulfúrico
- Conversión entre moles de H2SO4 y número de partículas (átomos o moléculas)
Cada una de estas conversiones requiere el uso adecuado de los coeficientes estequiométricos y las relaciones proporcionales entre las sustancias involucradas.
El ácido sulfúrico (H2SO4) es un compuesto químico versátil que puede participar en diversas conversiones químicas. Estas conversiones permiten relacionar el ácido sulfúrico con otras sustancias y son fundamentales para entender sus propiedades y comportamiento en diferentes contextos.
Por qué es importante dominar las conversiones químicas en la química
En el fascinante mundo de la química, las conversiones químicas son fundamentales para comprender y dominar numerosos conceptos y procesos. Sin embargo, pueden resultar desafiantes para muchos estudiantes, ya que implican manipular cantidades y unidades de diferentes sustancias y compuestos.
Las conversiones químicas son esenciales para realizar cálculos precisos en los laboratorios, así como en la vida cotidiana. Nos permiten determinar la cantidad de reactivos necesarios para llevar a cabo una reacción química, calcular la cantidad de producto obtenido o estimar la eficiencia de un proceso químico.
Además, el dominio de las conversiones químicas nos permite relacionar diferentes unidades de medida, facilitando la comparación y comunicación de resultados. Esto resulta especialmente útil cuando trabajamos con diferentes sistemas de unidades, como el sistema métrico o el sistema internacional (SI).
¿Qué son los moles y por qué son importantes en las conversiones químicas?
Antes de profundizar en las conversiones químicas, es necesario comprender el concepto de los moles. Los moles son una unidad fundamental en química que se utiliza para expresar la cantidad de sustancia presente en una muestra.
Un mol se define como la cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas, iones, etc.) como átomos hay en 12 gramos del isótopo carbono-12. Esta definición nos permite establecer una relación entre la masa y el número de partículas de una sustancia determinada.
Los moles son cruciales en las conversiones químicas porque nos permiten realizar cálculos basados en la relación entre las cantidades de diferentes sustancias involucradas en una reacción química. Al conocer la cantidad de moles de un reactivo, podemos determinar la cantidad de moles de producto esperado, usando como base la estequiometría de la ecuación química equilibrada.
Por ejemplo, supongamos que queremos determinar cuántos moles hay en 30 gramos de ácido sulfúrico (H2SO4). Para realizar la conversión, necesitamos utilizar la masa molar del compuesto, que se calcula sumando las masas atómicas de cada uno de los átomos presentes en la fórmula química.
Masa molar(H2SO4) = (2 * masa atómica del hidrógeno) + masa atómica del azufre + (4 * masa atómica del oxígeno)
Una vez que conocemos la masa molar de H2SO4, podemos utilizar la siguiente relación:
Cantidad de moles = Masa dada / Masa molar
Aplicando esta fórmula, podemos calcular la cantidad de moles de H2SO4 presentes en 30 gramos de este compuesto. Este resultado será fundamental para llevar a cabo diversas conversiones químicas y realizar cálculos precisos en otras reacciones.
Conversión de unidades en las conversiones químicas
Además de los moles, las conversiones químicas también implican cambiar unidades de medida. En muchos casos, es necesario convertir entre diferentes sistemas de unidades o entre unidades más grandes y más pequeñas.
Para llevar a cabo estas conversiones de unidades, es fundamental utilizar factores de conversión. Los factores de conversión son relaciones establecidas entre diferentes unidades de medida que nos permiten realizar cálculos precisos.
Por ejemplo, si queremos convertir 30 gramos de H2SO4 en moles, necesitamos utilizar el factor de conversión relacionado con la masa molar del compuesto. Este factor nos permite cancelar las unidades de masa y obtener el resultado en moles.
Es importante recordar que al realizar conversiones químicas, siempre es necesario construir una cadena de conversiones utilizando los factores adecuados. Esto nos asegurará que nuestras unidades se cancelen correctamente y obtengamos el resultado deseado.
- Conversiones de unidades dentro del sistema métrico
- Conversiones entre el sistema métrico y el sistema internacional (SI)
- Conversiones entre diferentes unidades de volumen
Dentro del sistema métrico, las conversiones químicas generalmente implican cambiar las unidades de masa (gramos, kilogramos) a moles, ya sea utilizando la masa molar de un compuesto específico o la constante de Avogadro.
Las conversiones entre el sistema métrico y el sistema internacional (SI) pueden requerir factores de conversión adicionales para tener en cuenta las diferencias en las magnitudes de las unidades utilizadas en ambos sistemas.
En algunas reacciones químicas, también puede ser necesario convertir unidades de volumen, como litros o mililitros, en moles. Estas conversiones generalmente se basan en la relación entre el volumen y la concentración de una sustancia.
Dominar las conversiones químicas es fundamental para comprender y realizar cálculos precisos en numerosos procesos químicos. El uso adecuado de los moles y los factores de conversión nos permite relacionar diferentes unidades de medida y obtener resultados confiables y consistentes. Así que ¡no subestimes la importancia de las conversiones químicas y comienza a dominarlas al instante!
Preguntas frecuentes (FAQ)
1. ¿Cómo puedo convertir gramos a moles en química?
Puedes convertir gramos a moles dividiendo la cantidad de gramos por la masa molar del compuesto.
2. ¿Cuál es la fórmula para calcular la masa molar de un compuesto?
La masa molar de un compuesto se calcula sumando las masas atómicas de los elementos presentes en la fórmula química.
3. ¿Qué es un mol en química?
Un mol es una unidad de medida utilizada en química que representa una cantidad definida de partículas, equivalente a 6.022 x 10^23 átomos o moléculas.
4. ¿Por qué es importante convertir entre gramos y moles en química?
La conversión entre gramos y moles es importante en química porque permite relacionar la cantidad de sustancia con su peso, lo cual es fundamental para llevar a cabo cálculos estequiométricos y determinar proporciones en reacciones químicas.
5. ¿Cuál es la relación entre moles y átomos/moleculas en un compuesto?
La relación entre moles y átomos o moléculas en un compuesto está dada por el número de Avogadro (6.022 x 10^23), que establece que hay 6.022 x 10^23 átomos o moléculas en 1 mol de cualquier sustancia.
Entradas relacionadas