Cuantos elementos de la tabla periódica: Todo lo que necesitas saber sobre los 118 elementos
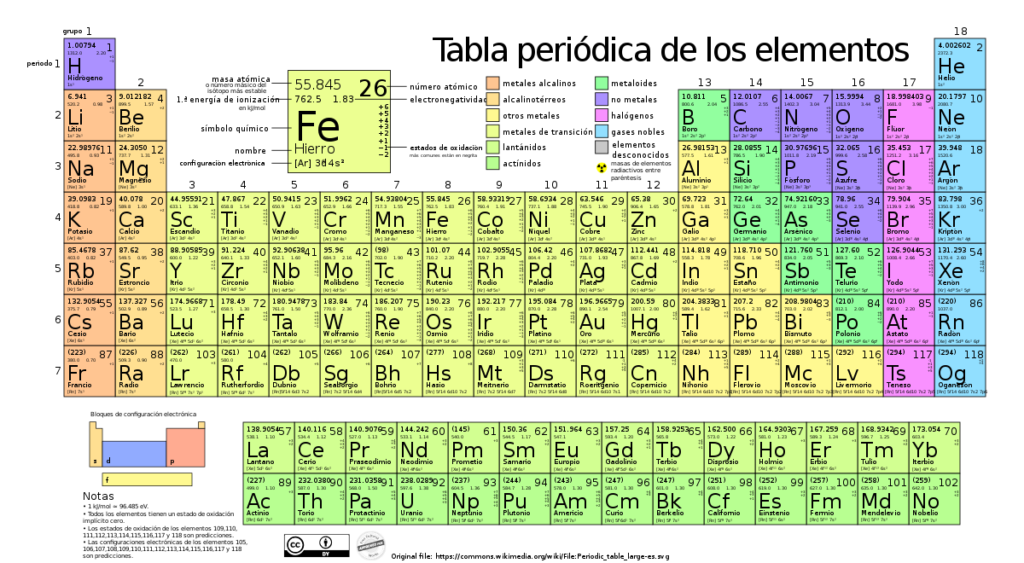
La tabla periódica es una herramienta fundamental para comprender la química y entender cómo están organizados los elementos en el universo. Creada en el siglo I por Dmitri Mendeléyev, ha ido evolucionando a lo largo del tiempo a medida que se han descubierto nuevos elementos. En la actualidad, la tabla periódica cuenta con 118 elementos, cada uno con sus propias características y propiedades.
Te presentaremos una detallada descripción de los 118 elementos de la tabla periódica. Exploraremos su símbolo, número atómico, masa atómica, configuración electrónica, grupo y periodo al que pertenecen, así como sus principales usos e importancia en diferentes campos como la industria, la medicina y la tecnología. Además, destacaremos algunos datos curiosos sobre ciertos elementos y hablaremos de aquellos que solo existen de forma sintética o en condiciones extremas.
- Cuál es el número total de elementos en la tabla periódica
- Cuáles son los nombres y símbolos de todos los elementos de la tabla periódica
- Cuántos elementos pertenecen a cada categoría de la tabla periódica (metales, no metales, metaloides)
- Qué propiedades físicas y químicas caracterizan a cada elemento individualmente
- Para qué se utiliza cada uno de los elementos de la tabla periódica en la vida cotidiana y en la industria
- Cuántos elementos son naturales y cuántos son sintéticos
- Cuáles son los elementos más comunes en la corteza terrestre
- Cuál es el elemento más ligero y cuál es el más pesado de la tabla periódica
- Cuáles son los elementos radioactivos de larga duración y cuál es su función en la ciencia y medicina
- Cuántos elementos tienen propiedades magnéticas
- Cuáles son los elementos más raros o menos comunes en la tabla periódica
- Por qué se siguen descubriendo nuevos elementos químicos y cómo se les asignan sus nombres y símbolos
- Existen elementos que aún no han sido descubiertos o que se predice que existan
- Cuáles fueron los primeros elementos descubiertos y cómo se realizó este proceso
- Cómo se clasifican los elementos según su estado físico a temperatura ambiente
- Preguntas frecuentes (FAQ)
Cuál es el número total de elementos en la tabla periódica
La tabla periódica es una herramienta fundamental en el estudio de la química y contiene información sobre los elementos químicos conocidos. Pero, ¿cuántos elementos hay en total en la tabla periódica?
Pues bien, actualmente la tabla periódica cuenta con un total de 118 elementos. Estos elementos se distribuyen en filas horizontales llamadas periodos y en columnas verticales llamadas grupos. Cada elemento tiene su propio número atómico y símbolo químico, que lo identifica de manera única.
Desde la creación de la tabla periódica por Dmitri Mendeléyev en 1869, se han descubierto y sintetizado diferentes elementos a lo largo de los años. Cada nuevo elemento añadido a la tabla periódica representa un avance en nuestra comprensión de la materia y su comportamiento químico.
Los elementos de la tabla periódica están ordenados en función de sus propiedades químicas y físicas. Así, podemos encontrar elementos metálicos, no metálicos y metaloides distribuidos de manera específica en la tabla periódica. Además, algunos elementos pueden presentar diferentes formas o alótropos, lo cual también se muestra en la tabla.
Es importante tener en cuenta que, aunque actualmente hay 118 elementos en la tabla periódica, esta cifra puede cambiar en el futuro a medida que se realicen nuevos descubrimientos o se sinteticen nuevos elementos en laboratorios especializados.
Elementos destacados en la tabla periódica
Dentro de los 118 elementos de la tabla periódica, existen algunos que son especialmente conocidos o destacables. Uno de ellos es el hidrógeno, que ocupa la primera posición en la tabla y es el elemento más ligero y abundante del universo.
Otro elemento destacado es el carbono, que es el pilar fundamental de la química orgánica y la base de la vida tal como la conocemos. Su capacidad para formar enlaces químicos con otros átomos de carbono y otros elementos permite la formación de moléculas complejas y numerosos compuestos orgánicos.
El oxígeno también es un elemento clave, ya que es esencial para la respiración y la combustión. Además, es uno de los principales componentes del agua y de muchos compuestos químicos presentes en nuestro entorno.
Estos son solo algunos ejemplos de los elementos destacados en la tabla periódica, pero cada uno de los 118 elementos tiene sus propias características y aplicaciones en diversas áreas de la ciencia y la tecnología.
Cuáles son los nombres y símbolos de todos los elementos de la tabla periódica
La tabla periódica es una herramienta fundamental en el estudio de la química. Permite organizar y clasificar todos los elementos conocidos, proporcionando información clave sobre sus propiedades y características. En la actualidad, la tabla periódica contiene un total de 118 elementos.
Cada elemento se identifica por su nombre y su símbolo químico único. El nombre del elemento suele reflejar algo sobre sus propiedades o su descubrimiento, mientras que el símbolo es una abreviatura utilizada para representar el elemento en fórmulas y ecuaciones químicas.
Los primeros 20 elementos de la tabla periódica
Comenzando desde el número atómico 1, los primeros 20 elementos de la tabla periódica son:
- Hidrógeno (H): Es el elemento más ligero y abundante en el universo. Su nombre proviene del griego "hydro" que significa agua, ya que forma parte de muchos compuestos químicos presentes en el agua.
- Helio (He): Es un gas noble inodoro e incoloro. Es el segundo elemento más ligero después del hidrógeno y es ampliamente utilizado en aplicaciones como la refrigeración y la resonancia magnética.
- Litio (Li): Es un metal alcalino que se encuentra en pequeñas cantidades en rocas y minerales. Se utiliza en la fabricación de baterías recargables y en medicamentos psiquiátricos.
- Berilio (Be): Es un metal grisáceo que se encuentra en minerales como la berilita. Es utilizado en la industria aeroespacial y nuclear debido a su resistencia y ligereza.
- Boro (B): Es un elemento no metálico que se encuentra en la corteza terrestre. Se utiliza en la fabricación de vidrio resistente al calor y en productos químicos industriales.
- Carbono (C): Es el bloque de construcción fundamental de la vida. Se encuentra en una variedad de formas, incluyendo diamantes y grafito, y es esencial en las moléculas orgánicas.
- Nitrógeno (N): Es un gas incoloro e inodoro que constituye aproximadamente el 78% de nuestra atmósfera. Es esencial para la vida y se utiliza en fertilizantes, explosivos y productos químicos industriales.
- Oxígeno (O): Es un gas altamente reactivo y vital para la respiración de los seres vivos. También está presente en la mayoría de los compuestos orgánicos e inorgánicos.
- Flúor (F): Es un gas amarillo pálido que se encuentra principalmente en minerales como la fluorita. Se utiliza en la producción de productos dentales y en el tratamiento del agua potable.
- Neón (Ne): Es un gas noble incoloro que se utiliza en letreros de neón y lámparas fluorescentes. También forma parte de la atmósfera, aunque en cantidades muy pequeñas.
- Sodio (Na): Es un metal blando y altamente reactivo que se encuentra abundantemente en la naturaleza. Es esencial para la vida y se utiliza en la fabricación de vidrio, productos químicos y explosivos.
- Magnesio (Mg): Es un metal liviano que se encuentra ampliamente distribuido en la corteza terrestre. Se utiliza en aleaciones metálicas, también es esencial para el funcionamiento de las células en los seres vivos.
- Aluminio (Al): Es un metal plateado que se encuentra en rocas y minerales como la bauxita. Es ampliamente utilizado en la industria de la construcción debido a su ligereza y resistencia a la corrosión.
- Silicio (Si): Es un elemento no metálico que se encuentra en la arena y otros minerales. Es esencial en la fabricación de semiconductores y componentes electrónicos.
- Fósforo (P): Es un elemento no metálico que se encuentra en alimentos, huesos y dientes. Es esencial para la vida y se utiliza en fertilizantes, detergentes y productos químicos industriales.
- Azufre (S): Es un elemento amarillo que se encuentra en forma elemental o en minerales como la pirita. Es utilizado en productos químicos, medicamentos y en la producción de fertilizantes.
- Cloro (Cl): Es un gas altamente reactivo que se encuentra principalmente en forma de cloruro de sodio en el agua de mar. Es ampliamente utilizado en la desinfección del agua y en productos químicos industriales.
- Argón (Ar): Es un gas noble incoloro que se encuentra en pequeñas cantidades en la atmósfera. Se utiliza en lámparas incandescentes y en aplicaciones de soldadura.
- Potasio (K): Es un metal blando y altamente reactivo que se encuentra en minerales como la carnalita y la langbeinita. Es esencial para el funcionamiento de las células en los seres vivos.
- Calcio (Ca): Es un metal alcalinotérreo que se encuentra en la corteza terrestre. Es esencial para la formación de huesos y dientes, y también se utiliza en la construcción y en productos lácteos.
Estos son solo los primeros 20 elementos de la tabla periódica. Cada uno de los 118 elementos tiene sus propias características y aplicaciones únicas en la ciencia y la tecnología. Espero que esta breve introducción te haya ayudado a comprender mejor la importancia de la tabla periódica y los elementos que la componen.
Cuántos elementos pertenecen a cada categoría de la tabla periódica (metales, no metales, metaloides)
La tabla periódica es una herramienta fundamental en la química y nos brinda información sobre los elementos que existen en el universo. Los elementos se clasifican en diferentes categorías, como metales, no metales y metaloides, según sus propiedades físicas y químicas.
Metales
Los metales constituyen la mayor parte de la tabla periódica y se encuentran agrupados en el lado izquierdo y el centro de la tabla. Son buenos conductores del calor y la electricidad, tienen brillo metálico, son maleables y ductiles. Algunos ejemplos de metales son el hierro, el cobre, el aluminio y el oro. Existen alrededor de 91 elementos clasificados como metales en la tabla periódica.
No metales
Los no metales se encuentran ubicados en la parte derecha de la tabla periódica. A diferencia de los metales, los no metales son malos conductores del calor y la electricidad, son frágiles y no tienen brillo metálico. En general, los no metales son pobres conductores de electricidad y tienen baja densidad. Algunos ejemplos de no metales son el oxígeno, el nitrógeno, el carbono y el flúor. En la tabla periódica encontramos aproximadamente 17 elementos clasificados como no metales.
Metaloides
Los metaloides, también conocidos como semimetales, son elementos que poseen características tanto de los metales como de los no metales. Estos elementos se encuentran ubicados en la "escalera" que separa a los metales de los no metales en la tabla periódica. Los metaloides tienen propiedades conductoras del calor y la electricidad intermedias entre los metales y los no metales, así como otras propiedades físicas y químicas peculiares. Algunos ejemplos de metaloides son el silicio, el germanio, el antimonio y el arsénico. En la tabla periódica encontramos alrededor de 7 elementos clasificados como metaloides.
La tabla periódica está compuesta por un total de 118 elementos, los cuales se dividen en distintas categorías. Aproximadamente 91 elementos son clasificados como metales, 17 son no metales y 7 son metaloides. Esta clasificación nos ayuda a comprender las propiedades y características de cada elemento, lo cual es fundamental en la química y en muchos otros campos de la ciencia.
Qué propiedades físicas y químicas caracterizan a cada elemento individualmente
Los elementos de la tabla periódica se clasifican según sus propiedades físicas y químicas. Cada elemento tiene características únicas que lo distinguen de los demás. Estas propiedades son fundamentales para comprender el comportamiento y las interacciones de los elementos en diferentes situaciones.
Propiedades físicas
Las propiedades físicas de los elementos se refieren a las cualidades innatas que pueden ser observadas o medidas sin alterar la composición química del elemento. Algunas de las propiedades físicas más comunes incluyen:
- Masa atómica: La masa promedio de los átomos de un elemento, expresada en unidades de masa atómica (u).
- Densidad: La relación entre la masa y el volumen de un elemento. Se expresa en gramos por centímetro cúbico (g/cm³).
- Punto de fusión: La temperatura a la cual un elemento cambia de estado sólido a líquido.
- Punto de ebullición: La temperatura a la cual un elemento cambia de estado líquido a gaseoso.
- Conductividad eléctrica: La capacidad de un elemento para conducir la corriente eléctrica.
- Conductividad térmica: La capacidad de un elemento para conducir el calor.
- Color: Los elementos pueden tener diferentes colores característicos cuando se encuentran en diversas formas o compuestos.
Propiedades químicas
Las propiedades químicas se relacionan con la capacidad de los elementos para interactuar y combinar con otros elementos y compuestos. Estas propiedades están determinadas por la configuración electrónica y la estructura de los átomos del elemento. Algunas de las propiedades químicas más importantes incluyen:
- Afinidad electrónica: La energía liberada o absorbida cuando un átomo gana un electrón.
- Electronegatividad: La capacidad de un átomo para atraer los electrones de un enlace químico.
- Reactividad: La tendencia de un elemento a participar en reacciones químicas.
- Potencial de ionización: La energía necesaria para remover un electrón de un átomo neutral en su estado fundamental.
- Valencia: El número de electrones que un átomo puede ganar, perder o compartir durante una reacción química.
- Estabilidad: La capacidad de un elemento para mantener su estructura y propiedades químicas sin descomponerse o reaccionar fácilmente.
Es importante destacar que estas propiedades pueden variar dentro de un mismo grupo o período en la tabla periódica. Además, algunos elementos presentan propiedades únicas y extraordinarias, como la superconductividad o ciertas características magnéticas.
Las propiedades físicas y químicas de los elementos de la tabla periódica son fundamentales para comprender la naturaleza y el comportamiento de la materia. Su estudio nos permite entender cómo se forman los enlaces químicos, cómo se producen las reacciones químicas y cómo se aplican estos conocimientos en diversos campos, como la medicina, la ingeniería y la industria.
Para qué se utiliza cada uno de los elementos de la tabla periódica en la vida cotidiana y en la industria
La tabla periódica de los elementos es una herramienta fundamental en la química y es utilizada tanto en la vida cotidiana como en la industria. En este artículo, te explicaremos para qué se utiliza cada uno de los 118 elementos presentes en esta tabla.
Gases nobles (Grupo 18)
- Helio (He): El helio se utiliza principalmente en la industria aeroespacial, ya que su baja densidad le permite ser utilizado en globos aerostáticos y dirigibles. También se usa en la medicina para enfriar equipos como resonancias magnéticas.
- Neón (Ne): El neón es conocido por su brillo característico, por lo que se utiliza en la industria de la publicidad y la iluminación. Además, también se utiliza para producir láseres y televisores de plasma.
- Argón (Ar): El argón se utiliza en la industria metalúrgica para proteger los metales durante su fundición y soldadura. También se emplea en la fabricación de lámparas de bajo consumo y en la producción de ventanas aislantes.
- Kriptón (Kr): El kriptón se utiliza en lámparas de neón y en dispositivos de iluminación de alta intensidad. También se ha utilizado en algunas aplicaciones médicas, como radioterapia y escáneres de resonancia magnética.
- enón (e): El xenón se utiliza en la industria de la iluminación, especialmente en lámparas de arco. También se emplea en la medicina en ciertos procedimientos diagnósticos y terapéuticos.
- Radón (Rn): El radón es un gas radiactivo y su principal aplicación es en la detección de fugas en materiales sellados. También se utiliza en la curación de ciertas enfermedades.
No metales (Grupo 17)
- Flúor (F): El flúor se utiliza en la fabricación de productos químicos, como los fluoropolímeros, que son resistentes a altas temperaturas y productos químicos. También se emplea en la prevención de caries dental.
- Cloro (Cl): El cloro se utiliza ampliamente como desinfectante en el tratamiento de agua potable y en sistemas de piscinas. También se emplea en la producción de plásticos y solventes orgánicos.
- Bromo (Br): El bromo se utiliza como retardante de llama en materiales de construcción y en productos electrónicos. También se utiliza en la producción de productos químicos para el tratamiento del agua.
- Iodo (I): El iodo se utiliza en medicina como desinfectante y también es necesario para la síntesis de hormonas tiroideas en el cuerpo humano.
- Astato (At): El astato es un elemento radioactivo y se utiliza en investigaciones científicas y médicas, especialmente en la radioterapia.
Gases Alcalinos (Grupo 1)
- Litio (Li): El litio se utiliza en la producción de baterías recargables utilizadas en dispositivos electrónicos, así como en aleaciones metálicas para fabricar componentes de aeronaves.
- Sodio (Na): El sodio se utiliza ampliamente en la industria alimentaria para la conservación y saborización de alimentos. Además, es un componente fundamental en la producción de vidrio y en la generación de energía eléctrica en pilas de combustible.
- Potasio (K): El potasio es esencial para el funcionamiento del cuerpo humano y se encuentra en alimentos como plátanos, patatas y tomates. También se utiliza en la industria como fertilizante y en la fabricación de jabones y detergentes.
- Rubidio (Rb): El rubidio se utiliza en la producción de células fotoeléctricas y de conductores térmicos. También se emplea en la investigación biomédica y en procedimientos diagnósticos por imagen.
- Cesio (Cs): El cesio se utiliza en relojes atómicos y en tecnología espacial. También se emplea en investigaciones científicas y médicas.
- Francio (Fr): El francio es un elemento altamente radiactivo y sus aplicaciones son principalmente en investigaciones científicas.
Cuántos elementos son naturales y cuántos son sintéticos
La tabla periódica es una herramienta fundamental en la química, ya que nos brinda información detallada sobre los elementos químicos conocidos. En total, hay 118 elementos en la tabla periódica, cada uno con su propio número atómico y símbolo químico único.
Es importante destacar que no todos los elementos son iguales. Existen dos tipos principales de elementos en la tabla periódica: los elementos naturales y los elementos sintéticos. Los elementos naturales son aquellos que se encuentran en la Tierra de forma natural, mientras que los elementos sintéticos son aquellos que han sido creados artificialmente por el ser humano.
Elementos naturales
Los elementos naturales son aquellos que se encuentran de forma natural en la Tierra y han existido desde hace millones de años. Estos elementos se originaron a partir de las reacciones nucleares en las estrellas y se formaron durante el proceso de evolución del universo. Algunos ejemplos de elementos naturales incluyen el oxígeno, el hidrógeno, el carbono, el nitrógeno, entre otros.
En la tabla periódica, los elementos naturales están representados por símbolos químicos únicos y se ordenan según su número atómico creciente. Esto significa que los elementos más ligeros, como el hidrógeno, tienen un número atómico menor, mientras que los elementos más pesados, como el uranio, tienen un número atómico mayor.
Elementos sintéticos
Los elementos sintéticos, por otro lado, son aquellos que han sido creados artificialmente por el ser humano. Estos elementos se producen mediante reacciones nucleares en laboratorios o reactores nucleares. A diferencia de los elementos naturales, los elementos sintéticos no se encuentran de forma natural en la Tierra y tienen una vida media muy corta.
Los científicos han logrado sintetizar varios elementos a lo largo de los años, incluyendo el tecnecio, el prometio y el plutonio. Estos elementos se han creado con fines científicos y tecnológicos, y su producción requiere condiciones especiales y equipos sofisticados.
Es importante mencionar que la síntesis de elementos sintéticos tiene implicaciones importantes en campos como la medicina nuclear, la tecnología de energía nuclear y la investigación científica. Al estudiar y comprender estos elementos, los científicos pueden avanzar en la comprensión de la física nuclear y desarrollar nuevas aplicaciones tecnológicas.
- Hay un total de 118 elementos en la tabla periódica.
- Los elementos naturales son aquellos que se encuentran de forma natural en la Tierra, mientras que los elementos sintéticos son creados artificialmente.
- Los elementos sintéticos se producen mediante reacciones nucleares en laboratorios o reactores nucleares.
La tabla periódica es una herramienta esencial en la química y nos proporciona información sobre los 118 elementos conocidos. Los elementos naturales y sintéticos juegan un papel importante en el avance científico y tecnológico, y su estudio continúa siendo una área de investigación fascinante en el campo de la química y la física nuclear.
Cuáles son los elementos más comunes en la corteza terrestre
o peso, resistencia a la corrosión y conductividad eléctrica.
4. Hierro (Fe): El hierro es un elemento vital para muchas industrias y se encuentra en gran cantidad en la corteza terrestre, representando cerca del 5%. Es utilizado principalmente en la producción de acero, que es fundamental en la construcción y fabricación de automóviles, maquinaria y herramientas.
5. Calcio (Ca): El calcio es otro elemento importante en la corteza terrestre, constituyendo aproximadamente el 3% de su masa. Es esencial para la salud ósea y dental en los seres humanos y también se utiliza en la agricultura para mejorar la calidad del suelo.
Además de estos elementos, hay otros que también son bastante comunes pero en menor cantidad. Estos incluyen el sodio, potasio, magnesio, titanio y muchos más. Todos estos elementos desempeñan un papel importante en la composición y las propiedades de la corteza terrestre.
En resumen, el oxígeno, silicio, aluminio, hierro y calcio son algunos de los elementos más abundantes en la corteza terrestre. Estos elementos tienen propiedades únicas y desempeñan un papel crucial tanto en la naturaleza como en la industria.
Cuál es el elemento más ligero y cuál es el más pesado de la tabla periódica
La tabla periódica es una herramienta fundamental en la química, ya que nos permite organizar y clasificar los diferentes elementos químicos de acuerdo a sus propiedades y características. En total, la tabla periódica cuenta con 118 elementos, desde el hidrógeno (H) hasta el oganesón (Og). Pero ¿cuál es el elemento más ligero y cuál es el más pesado de la tabla periódica?
El elemento más ligero: hidrógeno
El hidrógeno es el elemento más ligero de la tabla periódica. Su número atómico es 1 y su símbolo es H. Es el elemento más abundante en el universo y también en la composición del agua, donde se encuentra en forma de moléculas diatómicas (H2). A pesar de ser tan simple, el hidrógeno desempeña un papel crucial en la química y en fenómenos como la combustión y la producción de energía.
El elemento más pesado: oganesón
El oganesón es el elemento más pesado de la tabla periódica. Fue descubierto recientemente en el laboratorio en 2002 y su símbolo es Og. Este elemento superpesado fue creado a partir de la fusión de núcleos atómicos en aceleradores de partículas. Dado su alto número atómico, el oganesón es extremadamente inestable y su vida media es muy corta, lo que dificulta su estudio en condiciones normales.
A medida que avanzamos por la tabla periódica, los elementos se vuelven cada vez más pesados debido al aumento del número atómico. A partir del hidrógeno, los elementos se van organizando en diferentes grupos y periodos de acuerdo a sus propiedades químicas y físicas. Cada elemento tiene un conjunto único de electrones en su átomo, lo que determina sus propiedades específicas.
El hidrógeno es el elemento más ligero de la tabla periódica, mientras que el oganesón es el elemento más pesado. Estos dos extremos representan la diversidad de elementos presentes en nuestro mundo, desde los más simples hasta los más complejos. La tabla periódica sigue siendo una herramienta invaluable para comprender y estudiar la ciencia de la materia y la composición de nuestro universo.
Cuáles son los elementos radioactivos de larga duración y cuál es su función en la ciencia y medicina
En la tabla periódica, existen ciertos elementos que son considerados radioactivos de larga duración. Estos elementos emiten radiación de manera espontánea y continúan haciéndolo durante un periodo de tiempo prolongado. Esta característica los convierte en herramientas valiosas en diversas aplicaciones científicas y médicas.
Uno de los elementos radioactivos de larga duración más conocidos es el Uranio (U). El Uranio es utilizado como combustible en las plantas nucleares para generar energía eléctrica. Además, el Uranio también es utilizado en la producción de armas nucleares debido a su capacidad de liberar grandes cantidades de energía en forma de explosiones atómicas.
Otro elemento radioactivo de larga duración es el Plutonio (Pu). El Plutonio también es utilizado como combustible en las plantas nucleares, pero a diferencia del Uranio, puede ser producido artificialmente mediante reacciones nucleares. El Plutonio es extremadamente tóxico y altamente radiactivo, lo que lo convierte en un material peligroso si no se maneja adecuadamente.
El americio (Am) es otro elemento radioactivo de larga duración que tiene aplicaciones en la medicina. Se utiliza en la detección y tratamiento de diferentes tipos de cáncer, ya que emite radiación capaz de destruir las células cancerosas. También se utiliza en detectores de humo y en dispositivos de seguridad debido a su alta radiactividad.
Existen otros elementos radioactivos de larga duración, como el Curio (Cm), el Berkelio (Bk) y el Californio (Cf), que tienen diversas aplicaciones en la ciencia y medicina. Estos elementos son utilizados en investigaciones científicas, análisis de materiales y en la producción de radioisótopos para uso médico.
A pesar de las ventajas que ofrecen los elementos radioactivos de larga duración en campos como la energía y la medicina, es importante tener en cuenta los riesgos asociados con su uso. La radiación emitida por estos elementos puede ser dañina para la salud humana si se manejan de forma incorrecta o si no se toman las precauciones adecuadas. Por lo tanto, es fundamental contar con protocolos de seguridad y regulaciones estrictas para su manipulación y almacenamiento.
Cuántos elementos tienen propiedades magnéticas
En la tabla periódica existen varios elementos que presentan propiedades magnéticas, lo que significa que tienen la capacidad de interactuar con un campo magnético y generar una respuesta. La cantidad de elementos con estas características es variada y se encuentra dispersa a lo largo de la tabla.
Para entender mejor cuántos elementos tienen propiedades magnéticas, es importante conocer los diferentes tipos de magnetismo que se pueden encontrar en los materiales. Existen tres principales: paramagnetismo, diamagnetismo y ferromagnetismo.
Paramagnetismo
El paramagnetismo se presenta en aquellos elementos que tienen átomos o iones con electrones desapareados. Estos electrones, al no estar completamente apareados en pares, generan un momento magnético neto individual. Al colocar estos elementos en un campo magnético externo, los momentos magnéticos se alinean en la dirección del campo, lo que resulta en una atracción débil hacia el campo.
Un ejemplo de elemento paramagnético es el oxígeno (O). En su estado gaseoso, cada molécula de oxígeno tiene dos electrones sin aparear, lo que le confiere propiedades paramagnéticas.
Diamagnetismo
A diferencia del paramagnetismo, el diamagnetismo se presenta en todos los elementos, incluso aquellos que no tienen electrones desapareados. En este caso, cuando se aplica un campo magnético externo, los electrones de los átomos o iones se reorganizan ligeramente para formar bucles de corriente que generan un momento magnético opuesto al campo aplicado. Esto resulta en una repulsión débil a los campos magnéticos.
Un ejemplo de elemento diamagnético es el cobre (Cu). Aunque el cobre no tiene electrones desapareados, presenta propiedades diamagnéticas debido al movimiento de los electrones en su estructura atómica.
Ferromagnetismo
El ferromagnetismo es una propiedad exclusiva de algunos elementos y materiales. Estos elementos tienen átomos o iones con momentos magnéticos individuales que pueden alinearse entre sí, generando un campo magnético global más fuerte. Al aplicar un campo magnético externo, los momentos magnéticos se alinean en la misma dirección del campo, lo que resulta en una atracción fuerte hacia el campo.
Un ejemplo clásico de elemento ferromagnético es el hierro (Fe). El hierro tiene estructuras cristalinas especiales que permiten la alineación de sus momentos magnéticos individuales, lo que le confiere fuertes propiedades ferromagnéticas.
Existen diversos elementos en la tabla periódica con propiedades magnéticas, cada uno correspondiente a diferentes tipos de magnetismo. Algunos ejemplos incluyen el oxígeno como paramagnético, el cobre como diamagnético y el hierro como ferromagnético. Estas propiedades tienen aplicaciones en numerosos campos, desde la industria hasta la medicina, y son fundamentales para comprender el comportamiento de los materiales frente a campos magnéticos.
Cuáles son los elementos más raros o menos comunes en la tabla periódica
La tabla periódica de los elementos es una representación gráfica muy importante en el ámbito de la química. En ella se encuentran todos los elementos conocidos, organizados de acuerdo a su número atómico y propiedades químicas. Pero, ¿alguna vez te has preguntado cuáles son los elementos más raros o menos comunes en esta famosa tabla?
En total, existen 118 elementos en la tabla periódica actualmente reconocidos por la Unión Internacional de Química Pura y Aplicada (IUPAC). Sin embargo, algunos de estos elementos son extremadamente escasos y difíciles de encontrar en la naturaleza, lo que los convierte en elementos poco comunes y hasta casi desconocidos para muchos.
1. Francio (Fr)
El Francio es el elemento más raro de la tabla periódica. Es un metal alcalino altamente radioactivo y extremadamente inestable. Se encuentra en cantidades sumamente bajas en minerales de uranio, pero su vida media tan corta (menos de 22 minutos) hace que sea prácticamente imposible de obtenerlo en grandes cantidades para su estudio.
2. Astato (At)
El Astato es otro elemento raro y altamente radioactivo. Se encuentra en trazas en minerales de uranio y torio, pero al igual que el Francio, su vida media es muy corta, lo que dificulta su estudio en profundidad. Además, su peligrosidad y toxicidad también limitan su manejo seguro.
3. Polonio (Po)
El Polonio es otro elemento extremadamente raro y altamente radiactivo. Su presencia en la naturaleza es muy baja, ya que se encuentra como subproducto de la desintegración del uranio. Es conocido principalmente por su toxicidad y por haber sido utilizado como veneno en casos famosos.
4. Prometio (Pm)
El Prometio es un elemento poco común en la tabla periódica. Es radioactivo y no se encuentra en forma nativa en la Tierra. Se obtiene sintéticamente mediante la irradiación de neodimio con neutrones. Debido a su alta radiactividad, se utiliza principalmente con fines científicos e industriales.
5. Americio (Am)
El Americio es un elemento artificial y poco común en la Tierra. Se produce mediante reacciones nucleares en reactores nucleares o mediante el bombardeo de plutonio con partículas alfa. Su principal aplicación se encuentra en los detectores de humo ionizantes.
Aunque estos son solo algunos ejemplos de elementos raros o menos comunes en la tabla periódica, cada uno de ellos tiene sus propias características interesantes y únicas. La exploración y comprensión de estos elementos sigue siendo un campo emocionante para los científicos y químicos de todo el mundo.
Por qué se siguen descubriendo nuevos elementos químicos y cómo se les asignan sus nombres y símbolos
La tabla periódica de los elementos es una herramienta fundamental en la química, ya que nos muestra de manera organizada y clasificada todos los elementos conocidos hasta el momento. Sin embargo, esta tabla no está completa y sigue evolucionando con nuevos descubrimientos.
Cuando se habla de nuevos elementos químicos, nos referimos a aquellos que han sido sintetizados en laboratorio y no se encuentran de manera natural en nuestra Tierra. Estos elementos son creados mediante la técnica de aceleradores de partículas, donde se bombardean distintos núcleos atómicos con partículas aceleradas, como protones o neutrones, para fusionarlos y dar lugar a nuevos elementos.
El proceso de descubrir un nuevo elemento químico es complejo y requiere de un equipo de científicos altamente especializados. Primero, se debe generar una combinación de reactivos adecuada que permita llevar a cabo la reacción nuclear. Luego, se someten los núcleos atómicos a altas energías y se espera a que ocurra la fusión para observar los productos resultantes.
Una vez que se ha sintetizado un nuevo elemento, surge la tarea de asignarle un nombre y un símbolo. La Unión Internacional de Química Pura y Aplicada (IUPAC) es la entidad encargada de establecer las reglas y los criterios para nombrar a los nuevos elementos.
La IUPAC tiene un proceso definido para nombrar los elementos que se basa principalmente en honrar a científicos destacados, lugares geográficos, propiedades químicas o mitología. Es importante destacar que la IUPAC otorga la aprobación final para el nombre y símbolo propuesto por el equipo de descubrimiento.
Una vez que se ha determinado el nombre del nuevo elemento, se le asigna un símbolo químico. Estos símbolos son una abreviación de una o dos letras en mayúsculas, y en muchos casos están relacionados con el nombre del elemento, tomando las primeras letras o una combinación específica de estas.
Es interesante destacar que no todos los elementos sintetizados han sido reconocidos oficialmente por la IUPAC y, por lo tanto, no están incluidos en la tabla periódica. En algunos casos, puede llevar tiempo y múltiples confirmaciones experimentales para que un nuevo elemento sea aceptado y agregado a la tabla periódica.
La tabla periódica de los elementos continúa siendo una herramienta en constante evolución debido a los nuevos descubrimientos de elementos sintéticos. La IUPAC juega un papel fundamental al establecer los nombres y símbolos de estos nuevos elementos. Cada descubrimiento nos acerca más a comprender y explorar el vasto mundo de la química y sus fenómenos.
Existen elementos que aún no han sido descubiertos o que se predice que existan
La tabla periódica consta actualmente de 118 elementos conocidos, pero eso no significa que sea el número final. Todavía existen elementos que no han sido descubiertos o que se predice que existan.
Desde que Dmitri Mendeléyev desarrolló la tabla periódica en 1869, muchos científicos y expertos han estado trabajando en la búsqueda y síntesis de nuevos elementos. Aunque los 118 elementos actuales son suficientes para explicar la mayoría de las propiedades y comportamientos químicos, siempre existe una curiosidad por explorar más allá.
¿Cuántos nuevos elementos podrían existir?
No hay una respuesta definitiva a esta pregunta, ya que está en constante investigación y debate en la comunidad científica. Sin embargo, los científicos han realizado estimaciones basadas en las tendencias y patrones observados en la tabla periódica existente.
Algunas predicciones sugieren que podría haber otros elementos pesados más allá del elemento 118, los cuales estarían ubicados en la "isla de estabilidad". Esta región hipotética se encuentra en los números atómicos extremadamente altos y se caracteriza por tener núcleos atómicos más estables y de mayor duración que los elementos cercanos.
Además de los elementos desconocidos en los números atómicos más altos, también hay sugerencias de que podrían existir elementos adicionales que aún no se han encontrado en los números atómicos más bajos. Estos elementos teóricos desafiarían nuestras ideas actuales sobre la estructura atómica y abrirían nuevos campos de investigación en la química y la física.
¿Cómo se descubren nuevos elementos?
Descubrir y sintetizar nuevos elementos no es una tarea fácil. Requiere equipos de científicos altamente especializados y sofisticados.
Uno de los métodos utilizados para la síntesis de nuevos elementos es a través de la fusión nuclear, en la cual se bombardean núcleos atómicos con partículas cargadas para combinarlos y formar un elemento más pesado. Este proceso requiere de instalaciones avanzadas y aceleradores de partículas.
También se puede utilizar un enfoque inverso llamado fisión nuclear, en el cual se bombardea un núcleo grande para dividirlo en dos o más núcleos más pequeños, creando así elementos más livianos.
Una vez que se logra la síntesis de un nuevo elemento, los científicos deben someterlo a rigurosos procesos de verificación y confirmación para asegurarse de que sus propiedades sean consistentes con lo esperado y que pueda ser reconocido oficialmente en la tabla periódica.
La importancia de buscar nuevos elementos
La búsqueda y síntesis de nuevos elementos es fundamental para expandir nuestro conocimiento sobre la materia y los átomos. Cada elemento tiene su propia configuración electrónica y propiedades químicas únicas, lo que nos permite comprender mejor cómo se combinan y reaccionan las sustancias químicas.
Además, descubrir nuevos elementos podría tener aplicaciones prácticas en diversas áreas. Por ejemplo, algunos elementos sintéticos se utilizan en dispositivos electrónicos y tecnología avanzada. Además, el estudio de la estructura y propiedades de los nuevos elementos podría abrir nuevas puertas en la medicina, la energía y muchos otros campos.
Aunque la tabla periódica actualmente consta de 118 elementos conocidos, la búsqueda de nuevos elementos continúa. Las predicciones sugieren que podrían existir más elementos pesados y ligeros aún por descubrir. La síntesis de nuevos elementos requiere equipos especializados y técnicas avanzadas, pero su descubrimiento es crucial para ampliar nuestro entendimiento de la química y sus aplicaciones en diferentes áreas.
Cuáles fueron los primeros elementos descubiertos y cómo se realizó este proceso
El descubrimiento de los primeros elementos de la tabla periódica es uno de los hitos más importantes en la historia de la química. Fue un proceso largo y complejo que involucró a muchos científicos brillantes y experimentos meticulosos.
El primer elemento que se descubrió fue el hidrógeno, en el año 1766, por Henry Cavendish. Cavendish realizó una serie de experimentos utilizando gases y logró aislar el hidrógeno al combinar ácido clorhídrico con zinc. Este descubrimiento sentó las bases para el estudio de la química moderna.
Después del hidrógeno, el siguiente elemento en ser descubierto fue el oxígeno. Este importante descubrimiento se atribuye a Carl Wilhelm Scheele y Joseph Priestley, quienes trabajaron de manera independiente en la década de 1770. Scheele fue el primero en aislar el oxígeno a partir de diversos compuestos, mientras que Priestley logró obtenerlo al calentar óxido de mercurio.
Otros elementos que se descubrieron en los siglos VIII y I incluyen:
- El nitrógeno, descubierto por Daniel Rutherford en 1772.
- El fósforo, descubierto por Hennig Brand en 1669.
- El azufre, conocido desde la antigüedad pero no fue hasta el siglo VIII que fue reconocido como un elemento.
- El carbono, que ha sido conocido desde tiempos prehistóricos debido a su abundancia en la naturaleza.
Estos descubrimientos sentaron las bases para el desarrollo de la teoría atómica y la comprensión de los elementos y sus propiedades. A medida que avanzaba la ciencia, se fueron descubriendo más elementos, y en 1869 Dimitri Mendeléyev creó la primera versión de la tabla periódica moderna, ordenando los elementos según sus propiedades químicas.
El descubrimiento de los primeros elementos de la tabla periódica fue un proceso arduo y fascinante que sentó las bases para la química moderna. Gracias a los logros de científicos como Cavendish, Scheele, Priestley, Rutherford y Brand, hoy en día tenemos una visión mucho más clara de los elementos y su importancia en nuestro mundo.
Cómo se clasifican los elementos según su estado físico a temperatura ambiente
Los elementos de la tabla periódica se pueden clasificar de varias maneras según diferentes propiedades. Una de las formas más comunes de clasificación es por su estado físico a temperatura ambiente. A continuación, exploraremos esta clasificación y conoceremos los estados en los que se encuentran los elementos.
Elementos en estado sólido
La mayoría de los elementos de la tabla periódica se encuentran en estado sólido a temperatura ambiente. Estos elementos tienen una estructura cristalina y son caracterizados por ser rígidos y tener forma definida. Algunos ejemplos de elementos sólidos son el hierro (Fe), el carbono (C), el oxígeno (O) y el aluminio (Al).
Elementos en estado líquido
Existen pocos elementos que se encuentran en estado líquido a temperatura ambiente. Estos elementos son conocidos como "metales líquidos". El mercurio (Hg) es el ejemplo más común de un elemento líquido. A diferencia de los elementos sólidos, los metales líquidos tienen una densidad mayor y no presentan una forma definida.
Elementos en estado gaseoso
Un número relativamente pequeño de elementos se encuentran en estado gaseoso a temperatura ambiente. Estos elementos tienen moléculas que se dispersan fácilmente y no tienen forma ni volumen definidos. El hidrógeno (H), el oxígeno (O), el nitrógeno (N) y el helio (He) son ejemplos de elementos gaseosos.
Es importante destacar que la clasificación de los elementos según su estado físico varía dependiendo de las condiciones de temperatura y presión a las que sean sometidos. Algunos elementos pueden cambiar de estado al modificar estas condiciones, por ejemplo, el agua (H2O) que es líquida a temperatura ambiente, pero se convierte en vapor a altas temperaturas.
Los elementos de la tabla periódica se pueden encontrar en estado sólido, líquido o gaseoso a temperatura ambiente. Esta clasificación nos permite entender mejor las propiedades y comportamientos de los elementos y es fundamental para comprender la química y la ciencia en general.
Preguntas frecuentes (FAQ)
1. ¿Cuántos elementos hay en la tabla periódica?
Actualmente, existen 118 elementos en la tabla periódica.
2. ¿Cuál es el elemento más pesado de la tabla periódica?
El elemento más pesado de la tabla periódica es el Oganesón, con número atómico 118.
3. ¿Cuál es el elemento más liviano de la tabla periódica?
El elemento más liviano de la tabla periódica es el Hidrógeno, con número atómico 1.
4. ¿Cuántos elementos son naturales y cuántos son sintéticos?
De los 118 elementos, se considera que 90 son naturales y 28 son sintéticos o artificiales.
5. ¿Cuál es el símbolo químico del Oro?
El símbolo químico del Oro es "Au".
Entradas relacionadas