Contribución de la tabla periódica: Descubre la importancia clave en la química y más allá
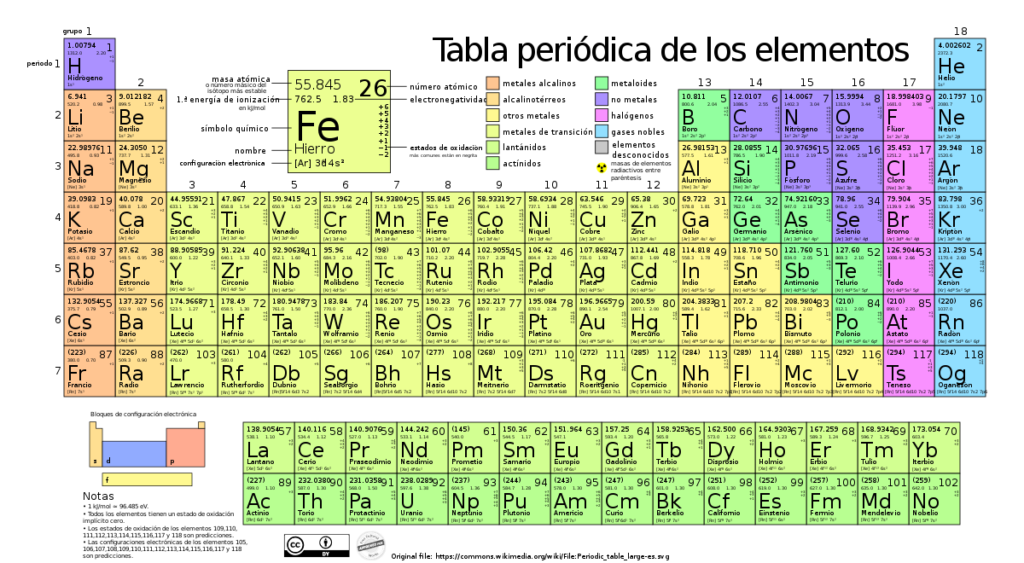
La tabla periódica es una herramienta fundamental en el campo de la química y tiene un papel crucial en nuestra comprensión de los elementos y sus propiedades. Fue creada por Dmitri Mendeléyev en 1869 y ha sido ampliamente utilizada desde entonces como una guía para organizar los elementos de acuerdo a su estructura y comportamiento químico.
Exploraremos la importancia de la tabla periódica en la química y cómo ha permitido avances significativos en el campo. También veremos cómo esta herramienta va más allá de la química, ya que ha influido en otras áreas como la física, la medicina y la industria. Descubriremos cómo la tabla periódica ha contribuido de manera clave en nuestro conocimiento científico y en muchos aspectos de nuestra vida diaria.
- Qué es la tabla periódica y por qué es importante en el campo de la química
- Cuál es la estructura y organización de la tabla periódica
- Cuántos elementos hay en la tabla periódica y cuáles son sus propiedades clave
- Cómo se clasifican los elementos en la tabla periódica
- Cuál es la historia y evolución de la tabla periódica
- Cuál es la importancia de los grupos y periodos en la tabla periódica
- Cómo se representan los elementos en la tabla periódica y cuál es la información que proporciona
- Cuáles son algunos ejemplos de elementos comunes y cómo se usan en la vida diaria
- Cuáles son los elementos más raros o poco conocidos en la tabla periódica
- De qué manera la tabla periódica ha influido en descubrimientos científicos y avances tecnológicos
- Cuáles son las aplicaciones prácticas de la tabla periódica en diferentes campos de estudio
- Cuál es el papel de la tabla periódica en la comprensión del átomo y las reacciones químicas
- Existe alguna controversia o desafío actual relacionado con la tabla periódica
- Qué podemos aprender de la tabla periódica sobre la composición del universo y la formación de los elementos
Qué es la tabla periódica y por qué es importante en el campo de la química
La tabla periódica es una herramienta fundamental en el campo de la química. Es un sistema de organización que clasifica y muestra todos los elementos químicos conocidos hasta ahora. Fue propuesta por primera vez por Dmitri Mendeléyev en 1869 y desde entonces ha sido ampliamente aceptada y utilizada por los científicos de todo el mundo.
La importancia de la tabla periódica radica en su capacidad para proporcionar información valiosa sobre los diferentes elementos químicos. Los elementos se organizan de acuerdo con su número atómico, su configuración electrónica y sus propiedades químicas. Esto permite a los científicos comprender mejor las relaciones entre los elementos y predecir su comportamiento químico.
La tabla periódica también proporciona una estructura clara y ordenada para estudiar los elementos. Cada elemento tiene su propio cuadro en la tabla, donde se muestra información detallada como su símbolo, su nombre, su número atómico y su masa atómica. También se pueden encontrar datos sobre su configuración electrónica y los grupos a los que pertenecen.
Clasificación de los elementos
La tabla periódica divide los elementos en diversos grupos y periodos. Los grupos representan columnas verticales y están organizados de tal manera que los elementos tienen propiedades similares. Por ejemplo, el grupo 1, conocido como los metales alcalinos, incluye elementos altamente reactivos como el hidrógeno, el litio y el sodio.
Por otro lado, los periodos representan filas horizontales y están basados en el número de niveles de energía o capas electrónicas que tienen los elementos. Cuanto más cerca esté un elemento del grupo 1, más enérgico será. A medida que se avanza en la tabla periódica hacia la derecha, los elementos tienden a volverse menos metálicos y más no metálicos.
Usos de la tabla periódica más allá de la química
Aunque la tabla periódica es una herramienta fundamental en el campo de la química, también tiene aplicaciones y usos más allá de esta ciencia.
En el ámbito de la física, la tabla periódica es crucial para comprender los enlaces químicos y las reacciones nucleares. Ayuda a los científicos a calcular masas moleculares y constantes de equilibrio, lo que a su vez permite desarrollar teorías y modelos que explican fenómenos físicos complejos.
Además, la tabla periódica es también muy valiosa en la medicina y la farmacología. Los conocimientos sobre los elementos y las interacciones entre ellos son esenciales para el desarrollo de nuevos fármacos y tratamientos médicos. La tabla periódica proporciona información precisa sobre los elementos necesarios y su comportamiento químico en el cuerpo humano.
Por último, pero no menos importante, la tabla periódica es una herramienta educativa poderosa. Es ampliamente utilizada en las escuelas y universidades para enseñar a los estudiantes sobre los elementos y sus propiedades. Brinda una estructura organizada que facilita la comprensión y el aprendizaje de la química y otras ciencias relacionadas.
La tabla periódica es una herramienta fundamental en el campo de la química y va más allá de esto, ya que también tiene aplicaciones en la física, la medicina y la educación. Su importancia radica en su capacidad para organizar y mostrar información valiosa sobre los elementos y sus propiedades, lo que permite a los científicos comprender mejor su comportamiento químico y utilizar ese conocimiento para avanzar en diversas áreas de la ciencia.
Cuál es la estructura y organización de la tabla periódica
La tabla periódica es una herramienta fundamental en el campo de la química y su importancia trasciende incluso esta disciplina. La estructura y organización de la tabla periódica es clave para comprender las propiedades de los elementos químicos y sus relaciones entre sí.
La tabla periódica está compuesta por filas horizontales llamadas periodos y columnas verticales conocidas como grupos o familias. Cada elemento químico se representa mediante un símbolo, que es una abreviatura de su nombre en general o una letra específica en algunos casos. Estos símbolos son reconocidos internacionalmente y facilitan la comunicación científica.
Periodos y sus características
En total, hay siete periodos en la tabla periódica, numerados del 1 al 7 de arriba hacia abajo. A medida que se desciende de un período a otro, el número de capas electrónicas aumenta, lo que resulta en una mayor distancia promedio entre el núcleo y los electrones. Esto se debe a que cada periodo representa una nueva capa electrónica agregada a los átomos.
Además de indicar el número de capas electrónicas, el periodo también permite identificar algunas tendencias en las propiedades de los elementos. Por ejemplo, en el primer período solo se encuentran los elementos hidrógeno y helio, mientras que en el segundo período se encuentran elementos tales como el litio, berilio, boro, carbono, nitrógeno, oxígeno, flúor y neón.
Grupos o familias y sus características
Los grupos de la tabla periódica son columnas verticales que comparten características comunes entre sus elementos. Algunos ejemplos de grupos importantes incluyen los metales alcalinos, los metales alcalinotérreos, los halógenos y los gases nobles, entre otros. Cada grupo se identifica con un número y una letra, como el Grupo 1A (también conocido como Grupo 1 o familia del hidrógeno) o el Grupo 7A (también conocido como Grupo 17 o familia de los halógenos).
Estos grupos nos permiten predecir propiedades químicas similares entre los elementos que los conforman. Por ejemplo, los metales alcalinos (Grupo 1) son altamente reactivos y tienden a perder un electrón para formar cationes con una carga de +1. Mientras tanto, los gases nobles (Grupo 18) son extremadamente estables debido a su configuración electrónica completa en la capa más externa.
Otras características de la tabla periódica
Además de los periodos y grupos, la tabla periódica también nos muestra otras características relevantes de los elementos. Esto incluye su número atómico (que indica la cantidad de protones en su núcleo), su masa atómica promedio (la suma de los protones y neutrones presentes en el núcleo) y su configuración electrónica (la distribución de electrones en las diferentes capas y subcapas).
La tabla periódica también utiliza colores y símbolos especiales para indicar diferentes categorías de elementos, como metales, no metales y metaloides. Además, se divide en bloques (s, p, d y f) que indican las capas y subcapas electrónicas en las que se encuentran los elementos.
Aplicaciones de la tabla periódica
La tabla periódica es una herramienta esencial para comprender y estudiar la química y sus aplicaciones prácticas. Gracias a su estructura y organización, nos permite predecir las propiedades de los elementos y sus compuestos, así como también entender las reacciones químicas y formular nuevas sustancias.
Además, la tabla periódica es clave en muchos otros campos más allá de la química. Por ejemplo, en física nuclear se utiliza para describir y clasificar los diferentes isótopos de los elementos. En bioquímica, nos ayuda a entender la composición química de los seres vivos y cómo interactúan los elementos en los procesos biológicos. Incluso en tecnología de materiales y exploración espacial, la tabla periódica es esencial para el desarrollo de nuevos materiales y la comprensión de la química presente en otros planetas y cuerpos celestes.
La estructura y organización de la tabla periódica son cruciales para comprender las propiedades y relaciones de los elementos químicos. Su estudio nos brinda una base sólida para explorar la química y su impacto en una amplia gama de disciplinas científicas y tecnológicas.
Cuántos elementos hay en la tabla periódica y cuáles son sus propiedades clave
La tabla periódica es un recurso invaluable en el campo de la química y más allá. En ella se encuentran organizados todos los elementos químicos conocidos, ordenados según sus propiedades y características. Actualmente, la tabla periódica cuenta con un total de 118 elementos, aunque no todos ellos se encuentran presentes de forma natural en nuestro planeta.
Cada elemento en la tabla periódica tiene su propio número atómico, que indica la cantidad de protones que hay en el núcleo de su átomo. Además, cada elemento posee una serie de propiedades clave que definen su comportamiento y su interacción con otros elementos.
¿Cuáles son algunas de estas propiedades clave?
Una de las propiedades más importantes es el peso atómico o masa atómica relativa, que nos indica cuánto pesa un átomo relativo al carbono-12. Esta propiedad es fundamental para calcular las cantidades de sustancias en reacciones químicas.
Otra propiedad clave es la valencia, que representa la capacidad de un átomo para combinarse químicamente con otros átomos. La valencia determina qué tipo de enlaces formarán los átomos y cómo se estructurarán las moléculas resultantes.
Además, otro aspecto crucial es el radio atómico, que mide el tamaño de un átomo. El radio atómico varía a lo largo de la tabla periódica debido a diferentes factores como la distribución electrónica y la carga nuclear efectiva.
Asimismo, la electronegatividad es otra propiedad relevante que marca la tendencia de un átomo a atraer electrones hacia sí mismo cuando forma enlaces químicos. La electronegatividad afecta la polaridad de las moléculas y determina las propiedades físicas y químicas de los compuestos.
Otro dato importante es el punto de ebullición y punto de fusión, que varían según el elemento y su estructura molecular. Estas propiedades influyen directamente en las temperaturas a las que los elementos cambian de estado líquido a gaseoso o sólido, respectivamente.
La tabla periódica también nos proporciona información sobre los distintos grupos y periodos en los que se dividen los elementos. Los grupos son columnas verticales que agrupan elementos con propiedades similares, mientras que los periodos son filas horizontales que indican la cantidad de capas electrónicas que tienen los átomos.
Aplicaciones más allá de la química
Aunque la tabla periódica es considerada como una herramienta fundamental en el estudio de la química, sus aplicaciones se extienden mucho más allá de esta disciplina. La tabla periódica ha sido utilizada en campos como la medicina, la física, la ingeniería de materiales y la biología, entre otros.
En medicina, por ejemplo, la tabla periódica juega un papel crucial en el desarrollo de nuevos medicamentos y en la comprensión de cómo interactúan los elementos con nuestro organismo. Además, los radiólogos dependen de elementos radiactivos presentes en la tabla periódica para realizar diagnósticos precisos mediante técnicas de imagenología.
En el campo de la física, la tabla periódica es esencial para entender las propiedades y comportamiento de los elementos en la materia. Muchos avances en la tecnología han sido posibles gracias al descubrimiento y análisis de nuevos elementos químicos.
La ingeniería de materiales también se beneficia ampliamente de la tabla periódica, ya que permite comprender cómo se pueden combinar diferentes elementos para crear aleaciones metálicas con propiedades únicas, como aceros especiales o superconductores.
Incluso en biología, aunque a primera vista pueda parecer menos relevante, la tabla periódica es fundamental para estudiar los elementos traza presentes en los seres vivos y comprender su función en los procesos bioquímicos.
La tabla periódica es una herramienta imprescindible en el estudio de la química y desempeña un papel fundamental en numerosas ramas científicas. Sus propiedades clave y la organización de los elementos nos permiten entender cómo interactúan los átomos y cómo se forman los distintos compuestos y materiales que nos rodean. Además, su aplicación se extiende a otros campos científicos, contribuyendo al avance y desarrollo de la medicina, la física, la ingeniería y la biología.
Cómo se clasifican los elementos en la tabla periódica
La tabla periódica es una herramienta fundamental en la química y otras disciplinas científicas. Permite organizar y clasificar los elementos de acuerdo a sus propiedades y características comunes. Pero, ¿cómo se lleva a cabo esta clasificación?
Los elementos en la tabla periódica se clasifican principalmente en función de su estructura electrónica y sus propiedades químicas. La estructura electrónica se refiere a la distribución de electrones en los diferentes niveles de energía alrededor del núcleo atómico.
Existen diferentes bloques en la tabla periódica, cada uno con un conjunto único de propiedades. Los elementos se agrupan en bloques s, p, d y f.
Bloque s
El bloque s contiene los elementos que tienen sus electrones de valencia en el orbital s. Estos elementos son altamente reactivos y se ubican en las dos primeras columnas de la tabla periódica, conocidas como los metales alcalinos y los metales alcalinotérreos.
Por ejemplo, el hidrógeno y el litio pertenecen al grupo 1 de la tabla periódica, mientras que el calcio y el magnesio se encuentran en el grupo 2. Estos elementos son importantes en nuestras vidas diarias, ya que se utilizan en diversas aplicaciones, desde baterías hasta fertilizantes.
Bloque p
En el bloque p se encuentran los elementos cuyos electrones de valencia están en los orbitales p. Estos elementos incluyen a los no metales, como el oxígeno, el nitrógeno y el carbono, así como también a los metaloides, como el silicio y el germanio.
Los elementos del bloque p tienen una amplia variedad de propiedades y se utilizan en múltiples sectores. Por ejemplo, el oxígeno es esencial para la respiración, mientras que el carbono es fundamental para la formación de compuestos orgánicos.
Bloque d
El bloque d comprende los elementos de transición, que tienen sus electrones de valencia en orbitales d. Estos elementos tienen propiedades metálicas y están ubicados en el medio de la tabla periódica.
Los elementos de transición tienen una gran importancia en la industria y la tecnología. Por ejemplo, el hierro se utiliza para fabricar estructuras metálicas, el cobalto se emplea en baterías recargables y el oro es valorado por su belleza y conductividad eléctrica.
Bloque f
Por último, el bloque f está compuesto por los elementos de la serie de los lantánidos y actínidos, que tienen sus electrones de valencia en los orbitales f. Estos elementos son altamente radiactivos y se encuentran en las filas inferiores de la tabla periódica.
Aunque muchos de estos elementos no se encuentran en la naturaleza en grandes cantidades, tienen aplicaciones importantes en la medicina, la energía nuclear y otros campos científicos. Por ejemplo, el uranio se utiliza como combustible en reactores nucleares.
La clasificación de los elementos en la tabla periódica se basa en su estructura electrónica y sus propiedades químicas. Los bloques s, p, d y f agrupan a los elementos de acuerdo a sus características comunes, lo que nos permite entender mejor las propiedades y comportamiento de estos elementos en la química y más allá.
Cuál es la historia y evolución de la tabla periódica
La tabla periódica es una herramienta fundamental en el estudio de la química. A lo largo de los años, ha experimentado una evolución significativa y ha jugado un papel clave en el avance de esta ciencia.
La historia de la tabla periódica comenzó en el siglo I con los primeros intentos de clasificar los elementos químicos conocidos. Uno de los primeros científicos en hacerlo fue Dmitri Mendeléyev, quien en 1869 presentó su versión inicial de la tabla periódica. Su propuesta se basaba en organizar los elementos en función de sus propiedades químicas y establecer relaciones entre ellos.
A medida que se descubrían nuevos elementos, la tabla periódica se iba expandiendo y perfeccionando. Nuevas filas y columnas fueron agregadas para acomodar a los elementos recién descubiertos y se establecieron nuevas reglas para su clasificación.
Conforme avanzaba el siglo , la tabla periódica también fue objeto de revisiones más profundas. Los avances en la comprensión de la estructura atómica permitieron organizar los elementos de acuerdo a su número atómico y configuración electrónica, lo que llevó a una versión más precisa y completa de la tabla.
Hoy en día, la tabla periódica consta de 118 elementos conocidos, ordenados en filas llamadas periodos y columnas llamadas grupos. Cada elemento está representado por un símbolo químico y su posición en la tabla revela información importante sobre sus propiedades físicas y químicas.
Importancia de la tabla periódica en la química
La tabla periódica es una herramienta esencial para los químicos y científicos en general. Su estructura organizada permite identificar patrones y relaciones entre los elementos, lo que facilita el estudio de las propiedades de la materia.
Una de las principales utilidades de la tabla periódica es predecir el comportamiento químico de los elementos. Gracias a su organización, es posible determinar cómo reaccionará un elemento con otros y prever los productos de una reacción química.
Además, la tabla periódica es fundamental para entender la estructura de los átomos y las propiedades de los elementos. A través de ella, podemos conocer la distribución de electrones en los distintos niveles de energía, así como la capacidad de un átomo para formar enlaces químicos.
Otro aspecto importante de la tabla periódica es su relevancia en la clasificación y nomenclatura de compuestos químicos. Gracias a la organización de los elementos, es posible determinar la fórmula química de una sustancia y darle un nombre específico basado en la combinación de elementos presentes.
La tabla periódica es una herramienta invaluable en la química. A través de ella, es posible comprender y estudiar las propiedades de los elementos, predecir su comportamiento químico y clasificar compuestos químicos de manera precisa.
Cuál es la importancia de los grupos y periodos en la tabla periódica
La tabla periódica es una herramienta fundamental en el estudio de la química y tiene una gran importancia en diversas áreas más allá de esta ciencia. Una de las características más destacadas de la tabla periódica son los grupos y periodos, los cuales juegan un papel clave en la organización de los elementos y en la comprensión de sus propiedades.
Los grupos de la tabla periódica
Los grupos son las columnas verticales en la tabla periódica y representan a los elementos que comparten características similares. Cada grupo se identifica con un número del 1 al 18 y algunas veces también se les asigna una letra. Estos grupos son fundamentales para entender las propiedades de los elementos y su comportamiento químico.
Algunos de los grupos más conocidos son:
- Grupo 1: Metales alcalinos (Litio, Sodio, Potasio, entre otros)
- Grupo 2: Metales alcalinotérreos (Berilio, Magnesio, Calcio, entre otros)
- Grupo 17: Halógenos (Flúor, Cloro, Bromo, entre otros)
- Grupo 18: Gases nobles (Helio, Neón, Argón, entre otros)
Cada grupo tiene características químicas específicas debido a la configuración electrónica de los elementos que lo componen. Por ejemplo, en el grupo 1 (metales alcalinos) todos los elementos tienen un electrón de valencia, lo que los hace altamente reactivos y propensos a perder este electrón para formar cationes positivos.
Los periodos de la tabla periódica
Los periodos son las filas horizontales en la tabla periódica y representan a los elementos que tienen el mismo número de capas electrónicas. Cada periodo se identifica con un número del 1 al 7. Los elementos dentro de un mismo periodo tienen una tendencia similar en términos de tamaño atómico y reactividad.
El primer periodo solo contiene dos elementos: Hidrógeno y Helio. A medida que avanzamos en los periodos, se van agregando más elementos, lo que implica un incremento en el número de capas electrónicas. Por ejemplo, en el tercer periodo encontramos elementos como Sodio y Magnesio, que tienen tres capas electrónicas.
La información proporcionada por los periodos es valiosa para entender cómo varían las propiedades de los elementos a medida que se mueven a través de la tabla periódica de izquierda a derecha. Por ejemplo, los elementos en el lado izquierdo de la tabla (periodos 1 y 2) tienden a ser muy reactivos debido a su tendencia a perder electrones, mientras que los elementos en el lado derecho de la tabla (periodos más altos) tienden a ser menos reactivos o incluso inertes.
Los grupos y periodos de la tabla periódica son elementos fundamentales para entender las propiedades y comportamiento de los elementos químicos. La organización sistemática de la tabla periódica nos permite visualizar patrones y tendencias que facilitan el estudio y aplicación de la química en distintos campos científicos y tecnológicos.
Cómo se representan los elementos en la tabla periódica y cuál es la información que proporciona
La tabla periódica es una herramienta fundamental en el campo de la química y más allá. Esta representación visual de los elementos químicos organizados por sus propiedades y características es una verdadera joya científica. A primera vista, la tabla periódica puede parecer abrumadora y complicada, pero en realidad es una fuente invaluable de información.
Cada elemento en la tabla periódica se representa con un símbolo único, que generalmente deriva de su nombre en latín o en otro idioma relevante. Por ejemplo, el símbolo del oro es "Au" debido a la palabra en latín "aurum". En la tabla periódica también encontramos el número atómico de cada elemento, que indica la cantidad de protones en el núcleo del átomo. El número atómico crece de izquierda a derecha y de arriba a abajo en la tabla periódica, lo que nos permite ordenar los elementos de acuerdo con su configuración electrónica y otras propiedades relacionadas.
Grupos y periodos en la tabla periódica
La tabla periódica se organiza en grupos y periodos. Los grupos, también conocidos como familias, son columnas verticales en la tabla. Cada grupo tiene características comunes y propiedades químicas similares. Un ejemplo familiar es el grupo 1, que incluye los metales alcalinos como el litio, el sodio y el potasio, todos ellos altamente reactivos y buenos conductores de electricidad.
Por otro lado, los periodos son filas horizontales y están numeradas del 1 al 7 en la tabla periódica. A medida que avanzamos de izquierda a derecha en un período, la cantidad de electrones en el nivel energético más externo aumenta gradualmente. Este aumento en los electrones determina la tendencia del elemento a participar en reacciones químicas.
Información adicional proporcionada por la tabla periódica
Además de los símbolos y los números atómicos, la tabla periódica nos brinda una gran cantidad de información valiosa. Por ejemplo, cada elemento se acompaña de su masa atómica, que es el promedio ponderado de las masas de los isótopos naturales de ese elemento. La masa atómica nos proporciona información sobre la cantidad de materia contenida en un mol de cualquier sustancia dada.
Otra información importante es el grupo y el periodo al que pertenece cada elemento. Esto nos ayuda a comprender mejor sus propiedades y comportamiento químico. Además de eso, la tabla periódica también muestra el estado de agregación a temperatura ambiente y presión atmosférica para algunos elementos, como el oxígeno, que es un gas, o el mercurio, que es un líquido a temperatura ambiente.
La tabla periódica también puede proporcionar información sobre los estados de oxidación de los elementos y sus configuraciones electrónicas, que son fundamentales para comprender cómo interactúan los átomos entre sí para formar compuestos químicos. Esta información es esencial para estudiar la estructura y la actividad de las sustancias químicas en diversos campos, desde la medicina hasta la ingeniería de materiales.
La tabla periódica no solo es un recurso útil para los químicos, sino que también es relevante en muchas otras disciplinas científicas. La información detallada que proporciona sobre los elementos y sus propiedades nos ayuda a comprender mejor el mundo que nos rodea y a avanzar en la búsqueda de soluciones innovadoras y sostenibles.
Cuáles son algunos ejemplos de elementos comunes y cómo se usan en la vida diaria
La tabla periódica de los elementos es una herramienta fundamental en la química y tiene una amplia gama de aplicaciones en nuestra vida diaria. Aunque hay muchos elementos presentes en la tabla periódica, algunos son más comunes y desempeñan un papel clave en numerosos procesos y productos que utilizamos a diario.
Oxígeno (O)
El oxígeno es uno de los elementos más abundantes en la tierra y es esencial para la vida tal como la conocemos. Es un componente crucial en la respiración celular y proporciona energía a nuestro cuerpo. Además, el oxígeno también se utiliza en la industria médica en forma de oxígeno medicinal para ayudar a las personas con problemas respiratorios.
Carbono (C)
El carbono es otro elemento vital presente en la tabla periódica. Es el bloque de construcción fundamental de la vida y forma la base de todas las moléculas orgánicas. El carbono se encuentra en muchos compuestos naturales y sintéticos, incluyendo medicamentos, plásticos, combustibles fósiles y alimentos. Sin el carbono, no existirían la mayoría de las cosas que encontramos en nuestro entorno cotidiano.
Hidrógeno (H)
El hidrógeno es el elemento más ligero y abundante en el universo. Se utiliza en una amplia gama de aplicaciones, desde la producción de amoníaco utilizado en fertilizantes hasta la producción de combustibles limpios como el hidrógeno líquido y células de combustible. Además, el hidrógeno es un componente clave del agua (H2O), que es esencial para la vida en la Tierra.
Hierro (Fe)
El hierro es un elemento comúnmente utilizado en la construcción y fabricación de estructuras metálicas debido a su resistencia y durabilidad. También desempeña un papel fundamental en nuestro organismo, ya que forma parte de la hemoglobina en los glóbulos rojos, transportando el oxígeno a través del cuerpo. Además, el hierro se utiliza ampliamente en la industria de la producción de acero y en la fabricación de imanes.
Aluminio (Al)
El aluminio es un metal versátil que se utiliza en una amplia gama de aplicaciones. Es liviano pero resistente, lo que lo convierte en un material ideal para la fabricación de aviones, automóviles y envases de alimentos. Debido a su alta conductividad térmica y eléctrica, el aluminio también se utiliza en cables eléctricos y en componentes electrónicos.
- Además de estos ejemplos comunes, hay muchos otros elementos presentes en la tabla periódica que se utilizan en diversos campos, como el cobre en la electricidad y la construcción, el zinc en las baterías y el azufre en la fabricación de productos químicos.
- La tabla periódica continúa siendo una herramienta invaluable en la investigación científica y el avance tecnológico. Nos proporciona información sobre los diferentes elementos, sus propiedades y sus interacciones, permitiéndonos comprender mejor el mundo que nos rodea.
La tabla periódica de los elementos es de vital importancia en la química y tiene un impacto significativo en nuestra vida diaria. Los elementos comunes mencionados anteriormente son solo ejemplos de cómo estos componentes básicos desempeñan roles clave en varios aspectos de nuestras vidas, desde la salud hasta la tecnología y la fabricación. La comprensión de la tabla periódica nos permite aprovechar al máximo estos elementos y seguir explorando las posibilidades que nos brindan.
Cuáles son los elementos más raros o poco conocidos en la tabla periódica
La tabla periódica es una herramienta fundamental en el estudio de la química. Es un recurso invaluable que nos brinda información sobre los elementos, sus propiedades y su organización. Sin embargo, mientras que algunos elementos son ampliamente conocidos y utilizados en diversas aplicaciones, existen otros que son más raros o poco reconocidos.
1. Fráncio (Fr)
El fráncio es el elemento más raro y escaso en la naturaleza. Este metal alcalino altamente reactivo se encuentra en cantidades muy limitadas en la corteza terrestre. Su rareza se debe a que su isotopo más estable, el fráncio-223, tiene una vida media de solo 22 minutos. A pesar de su rareza, el fráncio ha sido utilizado en investigaciones científicas, especialmente en estudios de radioactividad y otras propiedades nucleares.
2. Astato (At)
El astato es otro elemento extremadamente raro en la naturaleza. Pertenece al grupo de los halógenos y se caracteriza por ser altamente radioactivo. El astato se produce a partir de la desintegración del uranio, aunque en cantidades muy pequeñas. Debido a su radiactividad y corta vida media, el astato no tiene aplicaciones prácticas significativas fuera de la investigación científica.
3. Tenesina (Ts)
La tenesina es un elemento transactinídeo sintético que se produjo por primera vez en 2010 mediante la colisión de iones de calcio y átomos de americio en el Laboratorio Nacional de Dubna, en Rusia. El Ts es extremadamente inestable y se descompone rápidamente en otros elementos más ligeros. No obstante, su existencia es de gran importancia para comprender las propiedades de los elementos transactinídeos y expandir nuestra comprensión de la tabla periódica.
4. Roentgenio (Rg)
El roentgenio es un elemento sintético que fue descubierto por primera vez en 1994 en el Instituto GSI de Elementos Pesados en Alemania. Este metal pesado pertenece al grupo de los elementos transactinídeos y tiene propiedades químicas similares a las del mercurio. Sin embargo, debido a su corta vida media y su producción artificial, el roentgenio no tiene aplicaciones prácticas en la actualidad y su estudio se limita a la investigación científica.
5. Meitnerio (Mt)
El meitnerio es otro elemento sintético que fue descubierto en 1982 en el Instituto Central de Investigación Nuclear en Dubna, Rusia. Pertenece al grupo de los elementos transactinídeos y se produce bombardeando núcleos de bismuto con iones de hierro. Debido a su escasez y alta radioactividad, el meitnerio no tiene aplicaciones conocidas fuera del ámbito científico.
Aunque estos elementos son raros o poco conocidos, jugaron un papel crucial en ampliar nuestros conocimientos sobre la estructura atómica y las propiedades químicas. Su estudio nos permite comprender mejor el mundo de los elementos y su contribución a la ciencia.
De qué manera la tabla periódica ha influido en descubrimientos científicos y avances tecnológicos
La tabla periódica es una herramienta fundamental en el estudio de la química y ha sido crucial para numerosos descubrimientos científicos y avances tecnológicos a lo largo de la historia. Esta tabla, que agrupa y organiza los elementos químicos de acuerdo a sus propiedades y características, proporciona una estructura visual clara que permite entender la relación entre los diferentes elementos y analizar su comportamiento químico.
Una de las contribuciones más significativas de la tabla periódica ha sido la predicción de nuevos elementos químicos antes de su descubrimiento experimental. Gracias a la organización sistemática de los elementos en filas y columnas, los científicos han podido identificar huecos en la tabla que indicaban la existencia de elementos aún desconocidos. Estas predicciones han llevado al descubrimiento de varios elementos, incluyendo el escandio, el galio y el germanio.
Además, la tabla periódica ha permitido comprender patrones y tendencias en las propiedades de los elementos. Mediante el análisis de las filas horizontales (llamadas periodos) y las columnas verticales (llamadas grupos o familias), se pueden identificar similitudes en los comportamientos químicos y propiedades físicas de los elementos en un mismo grupo o periodo. Esta información ha sido fundamental para el desarrollo de teorías y modelos en química, tales como la teoría orbital y la estructura electrónica de los átomos.
Otro aspecto importante es la aplicación de la tabla periódica en la comprensión de reacciones químicas y la creación de nuevas sustancias. Al conocer las propiedades de los elementos y entender cómo interactúan entre sí, los científicos han podido diseñar y sintetizar compuestos químicos con propiedades específicas. Esta capacidad ha sido aprovechada en diversos campos, desde la producción de medicamentos y materiales semiconductores hasta la creación de nuevos pigmentos y catalizadores.
La tabla periódica también ha influido en el desarrollo de la tecnología. La comprensión de las propiedades de los elementos y su relación en la tabla ha permitido crear materiales más eficientes y mejorar el diseño de dispositivos electrónicos, baterías y superficies reactivas, entre otros. Además, la tabla periódica ha contribuido al avance de la energía, al facilitar el estudio de los elementos utilizados en la generación y almacenamiento de energía, como el litio en las baterías recargables o el silicio en las células fotovoltaicas.
La tabla periódica ha tenido un impacto significativo en el campo de la química y más allá. Desde predicciones de nuevos elementos hasta la comprensión de patrones y tendencias en las propiedades de los elementos, esta herramienta ha sido fundamental para el avance científico y tecnológico. Gracias a la tabla periódica, se ha logrado no solo profundizar nuestro conocimiento sobre la materia, sino también aplicarlo en la creación de nuevas sustancias y materiales con múltiples aplicaciones prácticas.
Cuáles son las aplicaciones prácticas de la tabla periódica en diferentes campos de estudio
La tabla periódica es una herramienta fundamental en el estudio de la química, pero su utilidad y aplicaciones van más allá de esta disciplina. En diferentes campos de estudio, la tabla periódica juega un papel crucial, permitiendo comprender y organizar los elementos químicos en función de sus propiedades y estructuras atómicas.
Química: la piedra angular de la tabla periódica
En el ámbito de la química, la tabla periódica es esencial para comprender las relaciones entre los elementos químicos. Permite clasificar los elementos según su número atómico, configuración electrónica y propiedades químicas. Además, proporciona información valiosa sobre la reactividad de los elementos y su capacidad para formar compuestos químicos. Gracias a la tabla periódica, los químicos pueden predecir cómo interactuarán los elementos y diseñar de manera más eficiente nuevas sustancias y compuestos químicos.
Física y ciencias de los materiales
La tabla periódica también es un recurso indispensable en el campo de la física y las ciencias de los materiales. Ayuda a comprender las propiedades físicas de los elementos y su relación con el comportamiento de los materiales. Por ejemplo, es posible predecir la conductividad eléctrica o térmica de un material basándose en su posición en la tabla periódica. Esto resulta especialmente útil en la creación y desarrollo de nuevos materiales con propiedades específicas.
Medicina y farmacología
En medicina y farmacología, la tabla periódica desempeña un papel vital. Permite a los científicos comprender la estructura y propiedades químicas de los elementos utilizados en medicamentos y tratamientos médicos. Además, el conocimiento de los elementos y sus interacciones ayuda en la investigación para desarrollar nuevos fármacos más eficientes y seguros.
Energía y medio ambiente
La tabla periódica también es de gran importancia en el campo de la energía y el medio ambiente. Ayuda a comprender el comportamiento de los elementos y sus aplicaciones en la producción y almacenamiento de energía. Por ejemplo, los elementos de la tabla periódica se utilizan en la fabricación de baterías y celdas solares. Además, el estudio de la tabla periódica permite comprender mejor las reacciones químicas involucradas en los procesos medioambientales, como la contaminación del aire y la calidad del agua.
Educación y divulgación científica
La tabla periódica cumple una función educativa y de divulgación científica. Es una herramienta visual que facilita la enseñanza y comprensión de los elementos químicos. Su organización y disposición permiten identificar patrones y tendencias dentro de la tabla, ayudando a los estudiantes a visualizar las relaciones entre los diferentes elementos.
La tabla periódica es mucho más que una simple lista de elementos. Su utilidad abarca múltiples campos de estudio, desde la química hasta la física, pasando por la medicina y el medio ambiente. Es una herramienta invaluable para científicos, investigadores y estudiantes que buscan entender y aplicar los fundamentos de la química y de otros campos relacionados.
Cuál es el papel de la tabla periódica en la comprensión del átomo y las reacciones químicas
La tabla periódica es una herramienta fundamental en la química y desempeña un papel crucial en nuestra comprensión del átomo y las reacciones químicas. Esta tabla icónica organiza los elementos químicos de acuerdo a su estructura atómica y proporciona información vital sobre sus propiedades físicas y químicas.
Una de las contribuciones más importantes de la tabla periódica es que nos ayuda a comprender la estructura de los átomos. Cada elemento está representado por un símbolo químico único, como "H" para el hidrógeno o "Na" para el sodio. Estos símbolos nos permiten identificar y distinguir entre los diferentes elementos presentes en la naturaleza. Además, cada elemento se encuentra en una posición específica en la tabla periódica de acuerdo a su número atómico, lo que indica el número de protones en el núcleo del átomo. Esto nos permite comprender la distribución de electrones en los átomos y cómo se relacionan con las propiedades químicas de cada elemento.
Otra contribución clave de la tabla periódica es que nos ayuda a predecir la reactividad química de los elementos. Los elementos están agrupados en filas llamadas períodos y columnas llamadas grupos. En general, los elementos en el mismo grupo tienen propiedades químicas similares debido a que tienen configuraciones electrónicas similares. Por ejemplo, todos los elementos del grupo 1, conocidos como metales alcalinos, tienden a ser altamente reactivos debido a que tienen un solo electrón de valencia que se pierde fácilmente durante las reacciones químicas. Esta tendencia se debe a la estructura de la tabla periódica, que permite identificar patrones en la reactividad de los elementos y predecir cómo se comportarán en diferentes condiciones químicas.
Además de su importancia en la química, la tabla periódica también ha tenido un impacto significativo en otras ramas de la ciencia. Por ejemplo, ha sido fundamental en el desarrollo de la física nuclear y la comprensión de la estructura de los núcleos atómicos. Además, la tabla periódica ha facilitado el descubrimiento de nuevos elementos y el desarrollo de la tecnología moderna. Los científicos continúan investigando y explorando la tabla periódica en busca de nuevos conocimientos y aplicaciones.
El futuro de la tabla periódica
A medida que avanzamos en el siglo I, la tabla periódica sigue siendo una herramienta esencial para los científicos y un símbolo universal del mundo de la ciencia. Aunque todavía hay áreas de la química que no están completamente comprendidas, como la física cuántica y las propiedades de materiales exóticos, la tabla periódica proporciona una base sólida para la investigación y el avance científico.
La tabla periódica desempeña un papel clave en la comprensión del átomo y las reacciones químicas. Proporciona una estructura organizada que nos ayuda a visualizar y comprender la diversidad de los elementos y cómo interactúan entre sí. Gracias a la tabla periódica, podemos predecir la reactividad química de los elementos y utilizar este conocimiento para desarrollar nuevos materiales y tecnologías. En definitiva, la tabla periódica es una herramienta esencial para los científicos y una ventana al mundo fascinante de la química.
Existe alguna controversia o desafío actual relacionado con la tabla periódica
La tabla periódica, esa matriz icónica de elementos químicos organizados en filas y columnas, ha sido durante mucho tiempo una herramienta invaluable para los científicos. Sin embargo, a pesar de su utilidad indiscutible, existen algunas controversias y desafíos actuales relacionados con la tabla periódica que merecen nuestra atención.
1. Elementos desafiantes
Uno de los principales desafíos asociados con la tabla periódica es la identificación y clasificación de nuevos elementos. Aunque hemos logrado identificar 118 elementos hasta la fecha, hay un interés constante en descubrir otros elementos más allá de este número. Sin embargo, esta tarea no es sencilla, ya que implica la síntesis y detección de elementos superpesados y altamente inestables. Los científicos están trabajando arduamente para superar este desafío y expandir aún más nuestro conocimiento de los elementos químicos.
2. Interpretación de las propiedades periódicas
La tabla periódica es conocida principalmente por sus propiedades periódicas, que se repiten de manera predecible a medida que avanzamos en las filas y columnas. Sin embargo, existe una continua discusión e investigación sobre cómo interpretar y comprender plenamente estas propiedades. Las teorías y modelos desarrollados para explicar las propiedades periódicas son objeto de debate y revisión constante en la comunidad científica. Los científicos buscan continuamente mejorar nuestra comprensión de las propiedades periódicas y cómo se relacionan con la estructura atómica y molecular.
3. Aspectos didácticos y de presentación
Otro desafío asociado con la tabla periódica está relacionado con su enseñanza y presentación en entornos educativos. La tabla periódica puede resultar abrumadora para los estudiantes debido a su complejidad y densidad de información. Los educadores se enfrentan al desafío de encontrar métodos efectivos y creativos para enseñar la tabla periódica de manera que sea accesible y comprensible para todos los estudiantes. Además, existen diferentes convenciones y formatos utilizados para presentar la tabla periódica, lo que puede generar confusión y dificultades adicionales para los estudiantes.
4. Elementos transuránicos y su uso
Los elementos transuránicos, aquellos que tienen números atómicos más altos que el uranio, presentan un desafío único en términos de su uso y manejo. Estos elementos son altamente radioactivos y presentan problemas significativos de seguridad y gestión de residuos. En la actualidad, existe una preocupación creciente sobre cómo manejar y eliminar adecuadamente estos elementos, especialmente considerando los posibles riesgos ambientales y de salud asociados con su almacenamiento a largo plazo.
Aunque la tabla periódica ha sido una herramienta esencial durante décadas, todavía enfrenta desafíos y controversias en el ámbito científico y educativo. Desde la identificación de nuevos elementos hasta la interpretación de las propiedades periódicas, los científicos están continuamente trabajando para mejorar nuestra comprensión y aplicación de este pilar fundamental de la química y más allá.
Qué podemos aprender de la tabla periódica sobre la composición del universo y la formación de los elementos
La tabla periódica es una de las herramientas más fundamentales en el estudio de la química. A primera vista, puede parecer una simple lista de elementos, pero en realidad, contiene información invaluable sobre la composición del universo y la formación de los elementos.
Para comprender la importancia de la tabla periódica, primero debemos entender su estructura y cómo se organiza. La tabla periódica se compone de filas horizontales llamadas periodos y columnas verticales llamadas grupos. Cada posición en la tabla representa un elemento químico único, que se identifica mediante su símbolo y número atómico.
La tabla periódica nos brinda información crucial sobre los átomos y sus propiedades. Por ejemplo, nos permite determinar la masa atómica de un elemento, que es la masa promedio de todos los isótopos de ese elemento. También nos muestra la configuración electrónica de cada elemento, lo cual es vital para entender las interacciones químicas.
Composición del universo
Uno de los hallazgos más fascinantes de la tabla periódica es su capacidad para revelar la composición del universo. La mayoría de los elementos en la tabla son naturales, lo que significa que se encuentran en el universo sin intervención humana. Estos elementos naturales están presentes en diversas formas, desde las estrellas hasta los planetas y todo lo que los rodea.
Mediante el análisis espectroscópico de la luz emitida por las estrellas, los científicos han sido capaces de identificar los elementos presentes en ellas. Al comparar estos datos con la tabla periódica, podemos determinar la abundancia relativa de los diferentes elementos en el universo. Esto nos ha llevado a descubrir que el hidrógeno es el elemento más abundante, seguido del helio, el oxígeno y el carbono.
Además, la tabla periódica también nos permite entender cómo se formaron los elementos en el universo. Los elementos más livianos, como el hidrógeno y el helio, se formaron principalmente durante el Big Bang, la explosión inicial que dio origen al universo. A medida que las estrellas se formaban y evolucionaban, comenzaron a fusionar estos elementos ligeros para producir elementos más pesados como el carbono, el nitrógeno y el hierro.
Aplicaciones prácticas en la química
Aparte de su utilidad en la cosmología, la tabla periódica tiene innumerables aplicaciones prácticas en el campo de la química. Nos proporciona información sobre las propiedades físicas y químicas de cada elemento, lo cual es fundamental para comprender cómo interactúan entre sí.
Por ejemplo, la tabla periódica nos permite predecir las reacciones químicas que pueden ocurrir entre dos elementos. Si conocemos la ubicación de los elementos en la tabla, podemos determinar si formarán compuestos iónicos, covalentes o metálicos, y qué tan fuertes serán esas interacciones.
También nos ayuda a entender las propiedades periódicas de los elementos, como su electronegatividad, radio atómico y energía de ionización. Estas propiedades son clave para entender cómo los elementos se comportan en diferentes entornos químicos.
Más allá de la química: aplicaciones en otras disciplinas
La tabla periódica no solo es relevante en el campo de la química, sino que también tiene aplicaciones en otras disciplinas como la física, la biología y la ingeniería. En la física, por ejemplo, la tabla periódica nos brinda información sobre los elementos utilizados en la fabricación de materiales conductores o semiconductores.
En la biología, la tabla periódica nos ayuda a comprender la estructura y función de los elementos presentes en los organismos vivos. Nos permite estudiar los elementos traza, aquellos que se encuentran en pequeñas cantidades pero juegan un papel crucial en los procesos biológicos.
Incluso en la ingeniería, la tabla periódica es fundamental para el diseño y desarrollo de nuevos materiales con propiedades específicas. Al comprender las propiedades de los elementos, podemos seleccionar los adecuados para cumplir con las necesidades de cada aplicación.
La tabla periódica es una herramienta invaluable en el estudio de la química y más allá. Nos permite comprender la composición del universo y la formación de los elementos, así como predecir reacciones químicas y entender propiedades periódicas de los elementos. Su aplicabilidad se extiende a disciplinas como la física, biología e ingeniería, donde desempeña un papel clave en el avance científico y tecnológico.
La tabla periódica clasifica y organiza los elementos químicos según sus propiedades, lo que permite identificar patrones y predecir el comportamiento de los elementos.
Actualmente, la tabla periódica contiene 118 elementos conocidos hasta la fecha.
Dmitri Mendeléyev fue el científico ruso que ideó la primera versión de la tabla periódica en 1869.
El oxígeno es el elemento más abundante en la Tierra, representando aproximadamente el 46% de la masa total de la corteza terrestre.
El flúor es considerado el elemento más reactivo de la tabla periódica, debido a su alta electronegatividad y capacidad para ganar electrones fácilmente.
Entradas relacionadas